
Главный комплекс гистосовместимости — большая область генома или большое семейство генов, обнаруженное у позвоночных и играющее важную роль в иммунной системе и развитии иммунитета. Название «комплекс гистосовместимости» эта область получила потому, что обнаружена она была при исследовании отторжения чужеродных тканей. Изучение свойств и функций продуктов генов МНС показало, что отторжение трансплантата организмом при несовпадении их МНС является экспериментальным артефактом, маскирующим истинную функцию МНС — презентацию антигена лимфоцитам для распознавания и удаления собственных изменённых клеток.

Танициты — специализированные эпендимные клетки биполярной формы, выстилающие дно третьего желудочка мозга и участвующие в обмене веществ между кровотоком и спинномозговой жидкостью. Длинные отростки таницитов углубляются в гипоталамус. Танициты образуются при развитии мозга из клеток радиальной глии, разделяют некоторые свойства с астроцитами, но также имеют свои уникальные морфологические, молекулярные и функциональные особенности.
Рецепторы, сопряжённые с G-белком,, также известные как семиспиральные рецепторы или серпентины, составляют большое семейство трансмембранных рецепторов. GPCR выполняют функцию активаторов внутриклеточных путей передачи сигнала, приводящими в итоге к клеточному ответу. Рецепторы этого семейства обнаружены только в клетках эукариот: у дрожжей, растений, хоанофлагеллят и животных. Эндогенные лиганды-агонисты, которые связываются и активируют эти рецепторы, включают гормоны, нейромедиаторы, светочувствительные вещества, пахучие вещества, феромоны и варьируются в своих размерах от небольших молекул и пептидов до белков. Нарушение работы GPCR приводит к возникновению множества различных заболеваний, а сами рецепторы являются мишенью до 40 % выпускаемых лекарств. Точный размер надсемейства GPCR не известен, но почти 800 различных человеческих генов были предсказаны из анализа последовательности генома. Несмотря на многочисленные схемы, было предложено разделить надсемейство на три основных класса.

Экспрессия генов — процесс, в ходе которого наследственная информация от гена преобразуется в функциональный продукт — РНК или белок. Некоторые этапы экспрессии генов могут регулироваться: это транскрипция, трансляция, сплайсинг РНК и стадия посттрансляционных модификаций белков. Процесс активации экспрессии генов короткими двухцепочечными РНК называется активацией РНК.

Интегрины — это трансмембранные гетеродимерные клеточные рецепторы, взаимодействующие с внеклеточным матриксом и передающие различные межклеточные сигналы. От них зависит форма клетки, её подвижность, они участвуют в регулировке клеточного цикла.

Альтернати́вный спла́йсинг — вариант сплайсинга матричных РНК (мРНК), при котором в ходе экспрессии гена на основе одного и того же первичного транскрипта (пре-мРНК) происходит образование нескольких зрелых мРНК. Структурные и функциональные различия образовавшихся транскриптов могут быть вызваны как выборочным включением в зрелую мРНК экзонов первичного транскрипта, так и сохранением в ней частей интронов. Наиболее распространённая разновидность альтернативного сплайсинга предусматривает пропуск экзона: отдельные экзоны транскрипта при определённых условиях могут быть как включены в зрелую мРНК, так и пропущены.
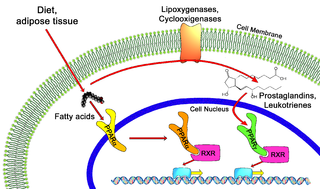
Рецепторы, активируемые пероксисомными пролифераторами — группа рецепторов клеточного ядра, функционирующих в качестве фактора транскрипции. PPARs играют существенную роль в регуляции клеточной дифференцировки, развития, метаболизма, онкогенеза у высших организмов.
Синдро́м Пендре́да — генетически обусловленное заболевание, характеризуется врождённой двусторонней нейросенсорной тугоухостью сочетающуюся с вестибулярными расстройствами и зобом, в некоторых случаях сочетающимся с гипотиреозом. Данный синдром является причиной 7,5% случаев врождённой глухоты.

Тирозиновая протеинфосфатаза C рецепторного типа — фермент, который кодируется у человека геном PTPRC. Альтернативными названиями данного фермента являются дифференцировочный антиген CD45 и LCA.
NLRP8 — цитозольный белок, Nod-подобный рецептор семейства NALP, продукт гена NLRP8, участвует в регуляции воспаления. Клонирован в 2003 году.
NLRC3 — цитозольный белок, Nod-подобный рецептор из подсемейства NOD, продукт гена NLRC3.

HER2 — мембранный белок, тирозиновая протеинкиназа семейства рецепторов эпидермального фактора роста EGFR/ErbB, кодируемый геном человека ERBB2. Амплификация или повышенная экспрессия гена этого белка играет важную роль в патогенезе и прогрессировании определённых агрессивных типов рака молочной железы, является важным биомаркером и терапевтической мишенью этого вида рака.
Коактиватор — белок, который увеличивает экспрессию генов путём связывания с активатором, который содержит ДНК-связывающий домен. Коактиватор не может связывать ДНК самостоятельно.
Корепрессор — вещество, которое ингибирует экспрессию генов. Для прокариот корепрессорами являются низкомолекулярные вещества или малые молекулы, тогда как в эукариотах, корепрессорами являются белки. Корепрессоры непосредственно не связывают ДНК, но вместо этого косвенно регулируют экспрессию гена путём связывания с репрессорами и усиливают или модулируют их действие.

Андроге́новый реце́птор, или андроге́нный рецептор, или NR3C4 — один из рецепторов стероидных гормонов, активируемый андрогенами — тестостероном или дигидротестостероном. Относится к подсемейству 3, группе С семейства ядерных рецепторов, способных непосредственно взаимодействовать с ядерной ДНК. Андрогеновый рецептор активируется при связывании с андрогенами в цитоплазме, а затем переносится в ядро.

Спираль-поворот-спираль — мотив в белках, способный взаимодействовать с ДНК. Он состоит из двух α-спиралей, соединенных короткой цепью аминокислот и входит в состав многих белков, регулирующих экспрессию генов. Не следует путать с доменом типа «спираль-петля-спираль».

3,5-Дийодотиронин (3,5-T2) — активный тиреоидный гормон из класса йодтиронинов. Имеет два атома йода в положениях 3 и 5 внутреннего кольца.

Интегральный мембранный белок NKG2-D II типа (NKG2-D type II integral membrane protein; CD314) — трансмембранный белок семейства CD94/NKG2 рецепторов лектина типа С, продукт гена человека KLRK1, локализованного NK-генном комплексе на 6-й хромосоме у мыши и 12-й хромосоме у человека. У человека белок экспрессирован на естественных киллерах, γδ-T-лимфоцитах и CD8+ αβ T-клетках и активированных макрофагах. NKG2D является рецептором к самоиндуцированным белкам-антигенам семейств MIC и RAET1/ULBP, которые появляются на поверхности клеток, находящихся в стрессовом состоянии, злокачественных клеток и инфицированных клеток.
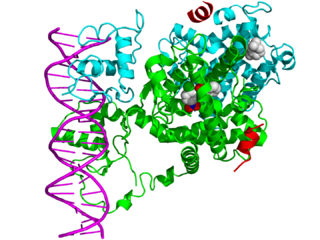
Ядерные рецепторы — это класс внутриклеточных белков, которые отвечают за восприятие стероидных и тиреоидных гормонов, а также некоторых других молекул. Уникальным свойством ядерных рецепторов, которое отличает их от других классов рецепторов, является их способность напрямую взаимодействовать с геномной ДНК и регулировать экспрессию соседних генов, тем самым контролируя развитие, гомеостаз и метаболизм организма. Следовательно, эти рецепторы классифицируются как факторы транскрипции. Регуляция экспрессии генов ядерными рецепторами обычно происходит только тогда, когда присутствует лиганд-молекула, которая влияет на поведение рецептора. Связывание лиганда с ядерным рецептором приводит к конформационному изменению рецептора, которое, в свою очередь, активирует рецептор, что приводит к усилению или понижению регуляции экспрессии гена.
Рецептор ретиноевой кислоты — ядерный рецептор. Действует, как фактор транскрипции, который активируется как полностью транс-ретиноевой кислотой, так и 9-цис-ретиноевой кислотой.












