Рибонуклеотид
| Рибонуклеотид | |
|---|---|
 Общая структура рибонуклеотида | |
| Классификация | |
| ChEBI | 26561 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Рибонуклеотид представляет собой нуклеотид, содержащий рибозу в качестве пентозного компонента. Считается молекулярным предшественником нуклеиновых кислот. Нуклеотиды являются основными строительными блоками ДНК и РНК. Сами рибонуклеотиды являются основными мономерными строительными блоками для РНК. Дезоксирибонуклеотиды, образующиеся в результате восстановления рибонуклеотидов ферментом рибонуклеотидредуктазой (RNR), являются важными строительными блоками ДНК[1]. Существует несколько различий между дезоксирибонуклеотидами ДНК и рибонуклеотидами РНК. Последовательные нуклеотиды связаны друг с другом с помощью фосфодиэфирных связей.
Рибонуклеотиды также используются в других клеточных функциях. Эти специальные мономеры используются как в клеточной регуляции, так и в передаче сигналов клетками, как показано в аденозинмонофосфате (AMP). Кроме того, рибонуклеотиды могут быть преобразованы в аденозинтрифосфат (АТФ), эквивалент энергии в организмах. Рибонуклеотиды могут быть преобразованы в циклический аденозинмонофосфат (циклический АМФ) для регулирования гормонов в организмах[1]. В живых организмах наиболее распространенными основаниями для рибонуклеотидов являются аденин (A), гуанин (G), цитозин (C) или урацил (U). Азотистые основания подразделяются на два исходных соединения, пурин и пиримидин.
Строение
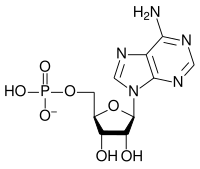
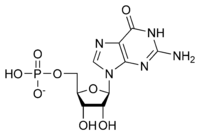


Общая структура
В состав рибонуклеотидов входят: остаток фосфорной кислоты, пентозный сахар рибоза и азотистое основание, в котором нуклеиновой основой может быть аденин, гуанин, цитозин или урацил. Без фосфатной группы состав нуклеиновой основы и сахара известен как нуклеозид. Взаимозаменяемые азотистые нуклеиновые основания получены из двух исходных соединений, пурина и пиримидина. Нуклеотиды представляют собой гетероциклические соединения, то есть они содержат по меньшей мере два разных химических элемента в качестве членов своих колец.
И РНК, и ДНК содержат два основных пуриновых основания, аденин (A) и гуанин (G), и два основных пиримидина. Как в ДНК, так и в РНК одним из пиримидинов является цитозин (С). Однако ДНК и РНК отличаются по второму основному пиримидину. ДНК содержит тимин (T), а РНК содержит урацил (U). В некоторых редких случаях тимин встречается в РНК, а урацил — в ДНК. Вот 4 основных рибонуклеотида (рибонуклеозид 5'-монофосфат), которые являются структурными единицами РНК.
| Нуклеотид | Символы | Нуклеозид |
|---|---|---|
| Аденилат (аденозин 5'-монофосфат) | А, АМФ | Аденозин |
| Гуанилат (гуанозин 5'-монофосфат) | G, ГМФ | Гуанозин |
| Уридилат (уридин 5'-монофосфат) | U, УМФ | Уридин |
| Цитидилат (цитидин 5'-монофосфат) | C, ЦМФ | Цитидин |
Сравнение дезоксирибонуклеотидов ДНК и рибонуклеотидов РНК
В рибонуклеотидах сахарным компонентом является рибоза, в то время как в дезоксирибонуклеотидах сахарным компонентом является дезоксирибоза. Вместо гидроксильной группы у второго углерода в рибозном кольце она заменена атомом водорода[2].
Оба типа пентоз в ДНК и РНК находятся в форме β-фуранозы (замкнутого пятичленного кольца), и они определяют идентичность нуклеиновой кислоты. ДНК определяется как содержащая 2'-дезокси-рибозную нуклеиновую кислоту, в то время как РНК определяется как содержащая рибозную нуклеиновую кислоту[1].
В некоторых случаях ДНК и РНК могут содержать некоторые второстепенные основания. Метилированные формы основных оснований наиболее распространены в ДНК. В вирусной ДНК некоторые основания могут быть гидроксиметилированными или глюкозилированными. В РНК минорные или модифицированные основания встречаются чаще. Некоторые примеры включают гипоксантин, дигидроурацил, метилированные формы урацила, цитозин и гуанин, а также модифицированный нуклеозид псевдоуридин[3]. Также наблюдались нуклеотиды с фосфатными группами в положениях, отличных от 5'-углерода. Примеры включают рибонуклеозид 2', 3'-циклические монофосфаты, которые являются изолируемыми промежуточными продуктами, и рибонуклеозид 3'-монофосфаты, которые являются конечными продуктами гидролиза РНК определёнными рибонуклеазами. Другие варианты включают аденозин 3',5'-циклический монофосфат (цАМФ) и гуанозин 3',5'-циклический монофосфат (цГМФ)[4].
Последовательное связывание нуклеотидов
Рибонуклеотиды связаны друг с другом с образованием цепей РНК посредством фосфодиэфирных связей. 5'-фосфатная группа одного нуклеотида связана с 3'-гидроксильной группой следующего нуклеотида, создавая основу из чередующихся остатков фосфата и пентозы. На каждом конце полинуклеотида нет фосфодиэфирной связи[5]. Фосфодиэфирные связи образуются между рибонуклеотидами с помощью фермента РНК-полимеразы. Цепь РНК синтезируется от 5'-конца до 3'-конца, поскольку 3'-гидроксильная группа последнего рибонуклеотида в цепи действует как нуклеофил и запускает гидрофильную атаку на 5'-трифосфат входящего рибонуклеотида, высвобождая пирофосфат в качестве побочного[6] продукта. Из-за физических свойств нуклеотидов остов РНК очень гидрофильный и полярный. При нейтральном рН нуклеиновые кислоты сильно заряжены, поскольку каждая фосфатная группа несет отрицательный заряд[7].
И ДНК, и РНК построены из нуклеозидфосфатов, также известных как мононуклеотидные мономеры, которые термодинамически менее склонны к объединению, чем аминокислоты. Фосфодиэфирные связи при гидролизе выделяют значительное количество свободной энергии. Поэтому нуклеиновые кислоты имеют тенденцию к самопроизвольному гидролизу в мононуклеотиды. Предшественниками РНК являются GTP, CTP, UTP и АТФ, которые являются основным источником энергии в реакциях переноса групп[8].
Функция
Предшественники дезоксирибонуклеотидов
Ученые считают, что РНК появилась раньше ДНК.
Восстановление рибонуклеотидов до дезоксирибонуклеотидов катализируется рибонуклеотидредуктазой. Рибонуклеотидредуктаза (RNR) является важным ферментом для всех живых организмов, поскольку она отвечает за последний этап синтеза четырёх дезоксирибонуклеотидов (dNTP), необходимых для репликации и репарации ДНК[9]. Для реакции также требуются два других белка: тиоредоксин и тиоредоксинредуктаза. Рибонуклеозиддифосфат (NDP) восстанавливается тиоредоксином до дезоксирибонуклеозиддифосфата (dNTP).
Общая реакция такова: рибонуклеозиддифосфат + NADPH + H+ -> дезоксирибонуклеозиддифосфат + NADP+ + H2O[10].
Чтобы проиллюстрировать это уравнение, dATP и dGTP синтезируются из ADP и GDP соответственно. Сначала они восстанавливаются с помощью RNR, а затем фосфорилируются нуклеозиддифосфаткиназами до dATP и dGTP. Рибонуклеотидредуктаза контролируется аллостерическими взаимодействиями. Как только dATP связывается с рибонуклеотидредуктазой, общая каталитическая активность фермента снижается, поскольку это означает обилие дезоксирибонуклеотидов. Это ингибирование обратной связи отменяется, как только АТФ связывается[11].
Различение рибонуклеотидов
Во время синтеза ДНК ДНК-полимеразы должны отбирать компонентов против рибонуклеотидов, присутствующих в гораздо более высоких концентрациях по сравнению с дезоксирибонуклеотидами. Крайне важно, чтобы была избирательность, поскольку репликация ДНК должна быть точной для поддержания генома организма. Было показано, что активные сайты ДНК-полимераз семейства Y отвечают за поддержание высокой селективности в отношении рибонуклеотидов[12]. Большинство ДНК-полимераз также оснащены для исключения рибонуклеотидов из их активного сайта через объемный остаток боковой цепи, который может стерически блокировать 2 '-гидроксильную группу рибозного кольца. Однако многие ядерные репликативные и репаративные ДНК-полимеразы включают рибонуклеотиды в ДНК[13][14], предполагая, что механизм исключения несовершенен[15].
Биологические функции в клетке
- Требуются для синтеза РНК,
- Многие ключевые молекулы в клетке являются рибонуклеотидами, либо рибонуклеотиды входят в их состав, например, АТФ, пиридоксальфосфат, НАД, кофермент А, ФАД.
Примечания
- ↑ 1 2 3 Nelson, David. Lehninger Principles of Biochemistry. — W H Freeman and Co., 2008. — P. 272–273.
- ↑ E. A. Newsholme. Functional biochemistry in health and disease. — Chichester, UK: Wiley-Blackwell, 2009. — xvi, 543 pages с. — ISBN 978-0-471-98820-5, 0-471-98820-0, 978-0-471-93165-2, 0-471-93165-9.
- ↑ Das, Debajyoti. Biochemistry. — Bimal Kumar Dhur of Academic Publishers, 2010.
- ↑ Michael M. Cox. Principles of Biochemistry. — W H Freeman & Co, 2008. — 1158 pages с. — ISBN 978-1-4292-2263-1, 1-4292-2263-8, 978-0-230-22699-9, 0-230-22699-X.
- ↑ Kenneth W. Raymond. General, organic, and biological chemistry : an integrated approach. — 3. ed. — Hoboken, NJ: Wiley, 2010. — Getr. Zählung. с. — ISBN 978-0-470-50476-5, 0-470-50476-5, 978-0-470-55124-0, 0-470-55124-0.
- ↑ The desk encyclopedia of microbiology. — 1st ed. — Amsterdam: Elsevier/Academic Press, 2004. — 1 online resource (1149 pages) с. — ISBN 978-0-08-047246-1, 0-08-047246-X, 1-280-96697-1, 978-1-280-96697-2, 9786610966974, 6610966974. Архивировано 25 января 2022 года.
- ↑ Molecular biology. — 3rd ed. — New York, NY: Taylor & Francis, 2005. — xiv, 370 pages с. — ISBN 0-415-35167-7, 978-0-415-35167-6.
- ↑ Nelson, David. Lehninger Principles of Biochemistry. — W H Freeman and Co, 2008. — P. 274–275.
- ↑ Maria del Mar Cendra, Antonio Juárez, Eduard Torrents. Biofilm modifies expression of ribonucleotide reductase genes in Escherichia coli // PloS One. — 2012. — Т. 7, вып. 9. — С. e46350. — ISSN 1932-6203. — doi:10.1371/journal.pone.0046350. Архивировано 22 сентября 2022 года.
- ↑ Mary K. Campbell. Biochemistry. — 7th ed. — Belmont, CA: Brooks/Cole, Cengage Learning, 2012. — 1 volume (various pagings) с. — ISBN 978-0-8400-6858-3, 0-8400-6858-1, 978-1-111-42564-7, 1-111-42564-7.
- ↑ Jeremy M. Berg. Biochemistry. — 6th ed. — New York: W.H. Freeman, 2007. — 1 volume (various pagings) с. — ISBN 0-7167-8724-5, 978-0-7167-8724-2, 0-7167-6766-X, 978-0-7167-6766-4. Архивировано 17 апреля 2009 года.
- ↑ Kevin N. Kirouac, Zucai Suo, Hong Ling. Structural Mechanism of Ribonucleotide Discrimination by a Y-Family DNA Polymerase (англ.) // Journal of Molecular Biology. — 2011-04. — Vol. 407, iss. 3. — P. 382–390. — doi:10.1016/j.jmb.2011.01.037. Архивировано 11 июня 2018 года.
- ↑ Stephanie A. Nick McElhinny, Dinesh Kumar, Alan B. Clark, Danielle L. Watt, Brian E. Watts. Genome instability due to ribonucleotide incorporation into DNA // Nature Chemical Biology. — 2010-10. — Т. 6, вып. 10. — С. 774–781. — ISSN 1552-4469. — doi:10.1038/nchembio.424. Архивировано 22 сентября 2022 года.
- ↑ Stephanie A. Nick McElhinny, Brian E. Watts, Dinesh Kumar, Danielle L. Watt, Else-Britt Lundström. Abundant ribonucleotide incorporation into DNA by yeast replicative polymerases // Proceedings of the National Academy of Sciences of the United States of America. — 2010-03-16. — Т. 107, вып. 11. — С. 4949–4954. — ISSN 1091-6490. — doi:10.1073/pnas.0914857107. Архивировано 21 сентября 2022 года.
- ↑ Rajesh Kasiviswanathan, William C. Copeland. Ribonucleotide discrimination and reverse transcription by the human mitochondrial DNA polymerase // The Journal of Biological Chemistry. — 2011-09-09. — Т. 286, вып. 36. — С. 31490–31500. — ISSN 1083-351X. — doi:10.1074/jbc.M111.252460. Архивировано 21 сентября 2022 года.