Сверхкритическая жидкость
Сверхкрити́ческий флюи́д (СКФ), сверхкрити́ческая жи́дкость — состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше[1] критической точки, является сверхкритической жидкостью. Свойства вещества в сверхкритическом состоянии – промежуточные, между его свойствами в газовой и жидкой фазе. Так, СКФ обладает высокой плотностью, близкой к жидкости, низкой вязкостью и при отсутствии межфазных границ поверхностное натяжение также исчезает. Коэффициент диффузии при этом имеет промежуточное значение между жидкостью и газом. Вещества в сверхкритическом состоянии могут применяться в качестве заменителей органических растворителей в лабораторных и промышленных процессах, наибольший интерес и распространение в связи с определенными свойствами получили сверхкритическая вода и сверхкритический диоксид углерода[англ.][2][3] (таковым он является, например, в нижних 5 км атмосферы Венеры).
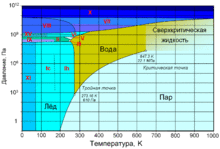
Свойства веществ в сверхкритическом состоянии

В Таблице 1 приведены критические параметры и молярная масса для практически наиболее применимых веществ.
| Растворитель | Молярная масса | Критическая температура, Tкрит | Критическое давление, Pкрит | Критическая плотность, ρкрит |
|---|---|---|---|---|
| г/моль | K | МПа (атм.) | г/см3 | |
| Диоксид углерода (CO2) | 44,01 | 303,9 | 7,38 (72,8) | 0,468 |
| Вода (H2O) | 18,015 | 647,096 | 22,064 (217,755) | 0,322 |
| Метан (CH4) | 16,04 | 190,4 | 4,60 (45,4) | 0,162 |
| Этан (C2H6) | 30,07 | 305,3 | 4,87 (48,1) | 0,203 |
| Пропан (C3H8) | 44,09 | 369,8 | 4,25 (41,9) | 0,217 |
| Этилен (C2H4) | 28,05 | 282,4 | 5,04 (49,7) | 0,215 |
| Пропилен (C3H6) | 42,08 | 364,9 | 4,60 (45,4) | 0,232 |
| Метанол (CH3OH) | 32,04 | 512,6 | 8,09 (79,8) | 0,272 |
| Этанол (C2H5OH) | 46,07 | 513,9 | 6,14 (60,6) | 0,276 |
| Ацетон (C3H6O) | 58,08 | 508,1 | 4,70 (46,4) | 0,278 |
| Аммиак (NH3) | 17,03 | 405,3 | 11,35 (115,7) | 0,322 |
| Ксенон (Xe) | 131,29 | 289,5 | 5,84 (58,4) | 1,110 |
Одно из наиболее важных свойств сверхкритического состояния — это способность к растворению веществ. Изменяя температуру или давление флюида, можно менять его свойства в широком диапазоне. Так, можно получить флюид, по свойствам близкий либо к жидкости, либо к газу. Растворяющая способность флюида увеличивается с увеличением плотности (при постоянной температуре). Поскольку плотность возрастает при увеличении давления, то меняя давление можно влиять на растворяющую способность флюида (при постоянной температуре). В случае с температурой зависимость свойств флюида несколько более сложная — при постоянной плотности растворяющая способность флюида также возрастает, однако вблизи критической точки незначительное увеличение температуры может привести к резкому падению плотности, и, соответственно, растворяющей способности[6].
Сверхкритические флюиды неограниченно смешиваются друг с другом, поэтому при достижении критической точки смеси система всегда будет однофазной. Приблизительная критическая температура бинарной смеси может быть рассчитана как среднее арифметическое от критических параметров веществ
- Tc(mix) = (мольная доля A) × TcA + (мольная доля B) × TcB.
Если необходима бо́льшая точность, то критические параметры могут быть рассчитаны с использованием уравнений состояния, например с помощью уравнения Пенга — Робинсона.[7]
Области применения
Сверхкритическая флюидная экстракция

Одной из наиболее широких областей применения флюидов является сверхкритическая флюидная экстракция. Самым распространенным растворителем для СКФ-экстракции является углекислый газ, так как он дешев, экологичен и имеет относительно невысокие критические температуру Tкрит и давление Pкрит.
СКФ-экстракция имеет ряд значительных преимуществ перед экстракцией органическими растворителями[8]:
- получаемый экстракт не нуждается в очистке от растворителя;
- экологичность процесса («зелёный процесс»);
- в некоторых случаях экстракция может быть селективной за счет контроля плотности растворителя.
Сверхкритическая флюидная хроматография
Сверхкритическая флюидная хроматография (СФХ) имеет ряд преимуществ перед жидкостной хроматографией (ЖХ) и газовой хроматографией (ГХ). В ней возможно применение универсальных пламенно-ионизационных детекторов (как и в ГХ и которые неприменимы в ЖХ), разделение термически нестабильных веществ, а также нелетучих веществ (в отличие от ГХ). Сейчас, несмотря на все преимущества, СФХ не нашла широкого применения (за исключением некоторых специфических областей, например, таких как разделение энантиомеров и высокомолекулярных углеводородов[9]. Несмотря на высокую чистоту получаемых при разделении соединений, высокая стоимость делает СКФ-хроматографию применимой только в случае использовании её для очистки или выделения дорогих веществ. Очень перспективна СКФ-хроматография и начинает активно использоваться, например, в фармацевтике.
Флюид как среда для проведения реакций
Уникальная способность сверхкритического флюида растворять большие объемы газа, в особенности H2 и N2, вкупе с высоким коэффициентом диффузии, делает чрезвычайно перспективным его использование в качестве растворителя.[10] Изменение температуры и давления позволяют влиять на свойства растворителя и маршрут реакции, что делает возможным более высокий выход целевого продукта.
История
Впервые сверхкритическое состояние вещества обнаружил Каньяр де ла Тур в 1822 году, нагревая различные жидкости в паровом автоклаве Папена. Внутрь автоклава он поместил кремниевый шарик. Сам де ла Тур работал в области акустики — в частности, ему принадлежит изобретение сирены. При встряхивании автоклава он слышал всплеск, возникавший, когда шарик преодолевал границу раздела фаз. Повторяя встряхивание в процессе дальнейшего нагревания, Каньяр де ла Тур заметил, что звук, издаваемый шариком при столкновении со стенкой автоклава, в определённый момент резко меняется — становится глухим и более слабым. Для каждой жидкости это происходило при строго определенной температуре, которую стали именовать точкой де ла Тура.
В двух опубликованных де ла Туром статьях в Annales de Chimie et de Physique описаны его эксперименты по нагреванию спиртов в запаянных стеклянных трубках под давлением. Он наблюдал, как по мере нагревания объём жидкости увеличивался в два раза, а затем она вообще исчезала, превращаясь в некое подобие газа и становясь прозрачной, так что казалось, что трубка пуста. При охлаждении наблюдалось образование плотных непрозрачных облаков (явление, которое сейчас принято называть критической опалесценцией). Также де ла Тур установил, что выше определенной температуры увеличение давления не приводит к образованию жидкости.
В последующих работах де ла Тур сообщает о серии схожих опытов с различными веществами. Он экспериментировал с водой, спиртом, эфиром и дисульфидом углерода.
Фарадей по достоинству оценил выполненную работу — в частности, в своем письме Уильяму Уэвелу он пишет: «Cagniard de la Tour made an experiment some years ago which gave me occasion to want a new word»; также в этом письме он указывает на то, что точка перехода жидкости в состояние флюида не была названа де ла Туром. В своих дальнейших работах Фарадей называет сверхкритическое состояние «состоянием де ла Тура», а саму точку фазового перехода точкой де ла Тура.
В своих работах Д. И. Менделеев в 1861 г. назвал критическую температуру температурой абсолютного кипения.
Термин «сверхкритический флюид» (supercritical fluid) был впервые введен в работах Т. Эндрюса в 1869 году. Проводя опыты в толстостенных стеклянных трубках, он измерял зависимость объема от давления и построил линии сосуществования двух фаз для углекислоты.
В 1873 году Ван дер Ваальс показал, что экспериментально найденные уравнения состояния Эндрюса могут быть объяснены количественно с использованием расширенной модели идеального газа, где в простой форме учтены молекулярные притяжение и отталкивание на близких расстояниях.
В начале XX века все методы построения уравнений состояния, базирующиеся на приближении среднего поля, были систематизированы в феноменологической теории Л. Д. Ландау, описывающей в том числе и сверхкритические фазовые переходы системы.[11][12]
Первое промышленное производство на основе применения сверхкритических флюидов заработало в 1978 году — это была установка по декофеинизации кофе, за ним в 1982 году последовала промышленная экстракция хмеля (для пивоваренной промышленности).[13]
Примечания и библиографические ссылки
- ↑ но давлении не более, чем давление перехода в твёрдую фазу при данной температуре (см. диаграмму)
- ↑ А. А. Галкин, В. В. Лунин. Вода в суб- и сверхкритическом состояниях — универсальная среда для осуществления химических реакций / Успехи химии, 74 (1), 2005.
- ↑ Кювета со сверхкритическим флюидом. Дата обращения: 14 мая 2009. Архивировано 27 сентября 2009 года.
- ↑ A.Baiker. Chem.Rev., 99, 453 (1999)
- ↑ R. van Eldik, C.D.Hubbard. Chemistry under Extreme or non-classic conditions. Wiley, New York, 1997
- ↑ Supercritical Fluid Extraction, Density Considerations. Дата обращения: 20 ноября 2007. Архивировано 28 апреля 2021 года.
- ↑ A.A. Clifford. Calculation of Thermodynamic Properties of CO2 using Peng Robinson equation of state. Critical Processes Ltd (4 декабря 2007). Дата обращения: 14 мая 2009. Архивировано из оригинала 31 марта 2012 года.
- ↑ Supercritical Fluid Extraction. Дата обращения: 14 мая 2009. Архивировано 31 марта 2012 года.
- ↑ Bart, C. J. Chapter 4: Separation Techniques // Additives in Polymers: industrial analysis and applications (англ.). — John Wiley and Sons, 2005. — P. 212. — ISBN 9780470012062. — doi:10.1002/0470012064.ch4.
- ↑ Сверхкритические среды. Новые химические реакции и технологии. Леменовский Д.А. Баграташвилли В.Н., 1999, ХИМИЯ. Дата обращения: 15 мая 2009. Архивировано 31 мая 2012 года.
- ↑ M.A.McHugh, V.J.Krukonis. Supercritical fluid extraction: principles and practice. Butterworth-Heinemann, Amsterdamm, 1994.
- ↑ Сверхкритическое состояние вещества: флюиды и сверхкритические флюидные технологии Архивная копия от 7 декабря 2013 на Wayback Machine.
- ↑ [ruscience.newmail.ru/physics/aqua_8.html Сверхкритическая вода].










