Свинцово-кислотный аккумулятор




Свинцо́во-кисло́тный аккумуля́тор — тип аккумуляторов, получивший широкое распространение ввиду умеренной стоимости, неплохого ресурса (от 500 циклов и более), высокой удельной мощности. Основные области применения: стартерные аккумуляторные батареи в транспортных средствах, аварийные источники электроэнергии, резервные источники энергии. Строго говоря, аккумулятором называется один элемент аккумуляторной батареи, но в просторечии «аккумулятором» называют аккумуляторную батарею (сколько бы в ней ни было элементов).
Аккумуляторная батарея, состоящая из свинцово-кислотных аккумуляторов, также сокращённо именуется АКБ (автомобильная кислотная батарея)[2].
Свинцово-кислотные аккумуляторы содержат около 85 % всего используемого в мире свинца, из-за чего представляют значительную опасность[3].
Классификация
AGM (от англ. absorbent glass mat) — аккумулятор, в котором между пластинами установлены абсорбирующие электролит маты из стекловолокна в роли сепараторов. Эти сепараторы не только предупреждают короткое замыкание пластин в случае их разрушения, губчатая конструкция сепараторов удерживает в них электролит за счёт капиллярных сил, и электролит не вытекает из батареи ни при каких обстоятельствах. Такие губчатые сепараторы, удерживая электролит, предупреждают его расслоение (стратификацию), что продляет срок службы аккумулятора. Также в аккумуляторах AGM работает цикл рекомбинации кислорода, что имеет как преимущества, так и недостатки. За счёт рекомбинации кислорода в аккумуляторах AGM расход воды меньше, чем в простых АКБ[2].
EFB (от англ. enhanced flooded battery, улучшенная наливная батарея) — аккумуляторная батарея со свободно плещущимся жидким электролитом, пластинами повышенной толщины в сравнении с простыми АКБ (такие же пластины, как в AGM) и c более плотной в сравнении с простыми АКБ конструкцией сепараторов. Среди прочих, у EFB встречаются сепараторы из стекловолокна (подобно AGM). Аккумуляторные батареи EFB занимают промежуточное положение между простыми АКБ и батареями AGM[2].
История
Свинцовый аккумулятор изобрёл в 1859—1860 годах Гастон Планте, сотрудник лаборатории Александра Беккереля[4]. В 1878 году Камилл Фор усовершенствовал его конструкцию, предложив покрывать пластины аккумулятора свинцовым суриком. Русский изобретатель Николай Бенардос применил покрытие губчатым свинцом для увеличения мощности батарей, которые использовал в своих работах со сваркой.
Принцип действия
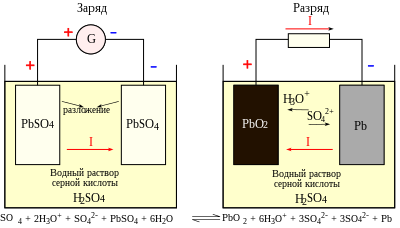
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к аккумулятору внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца (в классическом варианте аккумулятора). Проведённые в СССР исследования показали, что при разряде аккумулятора протекает как минимум ~60 различных реакций, порядка 20 из которых протекают без участия кислоты электролита[5].
Во время разряда происходит восстановление диоксида свинца на катоде[5][6] и окисление свинца на аноде. При заряде протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца, начинается электролиз воды, при этом на аноде (положительный электрод) выделяется кислород, а на катоде — водород.
Электрохимические реакции при разряде (при заряде идут те же реакции, но в обратную сторону):
- на катоде:
- .
- на аноде:
- .
При разомкнутой внешней цепи на аноде накапливаются свободные электроны, которые притягивают из электролита ионы . В тонком слое вблизи анода формируется электрическое поле, которое препятствует доступу ионов к электроду. По мере накопления отрицательного заряда разность потенциалов на таком тонком слое растёт, доступ отрицательных ионов к аноду замедляется, устанавливается равновесие, и заряд прекращает накапливаться на аноде. Аналогичная ситуация происходит на катоде: положительный заряд катода притягивает ионы , оттесняя ионы , реакция замедляется. При замыкании внешней цепи электроны анода перетекают на катод и нейтрализуют положительный заряд на нём, что способствует возобновлению химических реакций на электродах.
При разряде аккумулятора из электролита расходуется серная кислота и выделяется относительно более лёгкая вода, плотность электролита падает. При заряде происходит обратный процесс. В конце заряда, когда количество сульфата свинца на электродах снижается ниже некоторого критического значения, начинает преобладать процесс электролиза воды. Газообразные водород и кислород выделяются из электролита в виде пузырьков — так называемое «кипение» при перезаряде. Это нежелательное явление, при заряде его следует по возможности избегать, так как при этом вода необратимо расходуется, нарастает плотность электролита и есть риск взрыва образующихся газов. Поэтому большинство зарядных устройств снижает зарядный ток при повышении напряжения аккумулятора. Потери воды восполняют доливкой в аккумуляторы дистиллированной воды при обслуживании аккумуляторной батареи (некоторые автомобильные батареи не имеют открывающихся/отвинчивающихся пробок)[7].
Устройство
Элемент свинцово-кислотного аккумулятора состоит из электродов и разделительных пористых пластин, изготовленных из материала, не взаимодействующего с кислотой, препятствующих замыканию электродов (сепараторов), которые погружены в электролит. Электроды представляют собой плоские решётки из металлического свинца. В ячейки этих решёток запрессованы порошки диоксида свинца () — в анодных пластинах и металлического свинца — в катодных пластинах (здесь анодом при заряде аккумулятора считается положительный его электрод, ибо при разряде аккумулятора — он становится катодом, — как электрод к которому направлено движение электронов во внешней цепи). Применение порошков увеличивает поверхность раздела электролит — твердое вещество, тем самым увеличивает электрическую ёмкость аккумулятора.
Электроды вместе с сепараторами погружены в электролит, представляющий собой водный раствор серной кислоты. Для приготовления раствора кислоты применяют дистиллированную воду.
Электрическая проводимость электролита зависит от концентрации серной кислоты и при комнатной температуре максимальна при массовой доле кислоты 35 %[8], что соответствует плотности электролита 1,26 г/см³. Чем больше проводимость электролита, тем меньше внутреннее сопротивление аккумулятора, и, соответственно, ниже потери энергии на нём. Однако на практике в районах с холодным климатом применяются и более высокие концентрации серной кислоты, до 1,29−1,31 г/см³, потому что при снижении концентрации из-за разряда электролит может замёрзнуть с образованием льда, который повреждает губчатый материал пластин и может разорвать банки аккумулятора.
Существуют экспериментальные разработки аккумуляторов, где свинцовые решетки заменяют пластинами из переплетённых нитей углеродного волокна, покрытых тонкой свинцовой плёнкой. При этом используется меньшее количество свинца, распределённого по большой площади, что позволяет изготовить аккумулятор не только компактным и лёгким, при прочих равных параметрах, но и значительно более эффективным — помимо большего КПД, заряжается значительно быстрее традиционных аккумуляторов[9].
В аккумуляторах, применяемых в бытовых ИБП, систем охранной сигнализации и др. жидкий электролит загущают водным щелочным раствором силикатов натрия () до пастообразного состояния. Это так называемые гелевые аккумуляторы (GEL), имеющие длительный ресурс. Другой вариант исполнения − с пористыми сепараторами из стеклоткани (AGM), допускающими более жёсткие режимы заряда[10].
Электрические и эксплуатационные параметры
- Удельная предельная теоретическая энергоёмкость около 133 Вт·ч/кг.
- Удельная энергоёмкость: 25—40 Вт·ч/кг[11].
- ЭДС одного заряжённого аккумулятора 2,11—2,17 В, рабочее напряжение 2,1 В (3 или 6 аккумуляторов в итоге дают в батарее стандартные 6,3 В или 12,6 В соответственно)[5].
- Напряжение полностью разряженного аккумулятора 1,75—1,8 В. Ниже разряжать их нельзя[5].
- Рабочая температура: от −40 °C до +40 °C.
- КПД около 80—90 % (по току заряда-разряда). КПД по энергии 70—80 %[11].
Применение
Чаще всего свинцово-кислотные аккумуляторы применяются в составе аккумуляторной батареи с номинальным напряжением 4, 6 и 12 В, реже с другим напряжением, кратным 2 вольтам. Отдельные двухвольтовые элементы почти не применяются. Промышленность выпускает варианты обслуживаемых (заливание электролита, дистиллированной воды, контроль плотности электролита, его замена) и необслуживаемых аккумуляторных батарей (в герметичном корпусе, исключается проливание электролита при изменений наклонах и переворачиваниях). Обслуживаемые аккумуляторные батареи могут выпускаться сухозаряженными (без залитого электролита), что увеличивает их срок хранения и не требует периодического обслуживания при хранении, заливка электролита производится перед вводом батареи в эксплуатацию.
 Свинцово-кислотная аккумуляторная батарея напряжением 12 В и ёмкостью 7 А·ч и бытовой источник бесперебойного электропитания, в котором она применяется
Свинцово-кислотная аккумуляторная батарея напряжением 12 В и ёмкостью 7 А·ч и бытовой источник бесперебойного электропитания, в котором она применяется Вариант обслуживаемой свинцово-кислотной аккумуляторной батареи для автомототракторной техники в эбонитовом корпусе, в подобных батареях была даже возможность заменить отдельный вышедший из строя аккумулятор
Вариант обслуживаемой свинцово-кислотной аккумуляторной батареи для автомототракторной техники в эбонитовом корпусе, в подобных батареях была даже возможность заменить отдельный вышедший из строя аккумулятор Вариант необслуживаемой свинцово-кислотной аккумуляторной батареи для автомототракторной техники, нет доступа к заливным горловинам банок аккумуляторов
Вариант необслуживаемой свинцово-кислотной аккумуляторной батареи для автомототракторной техники, нет доступа к заливным горловинам банок аккумуляторов Свинцово-кислотные аккумуляторные батареи электромобиля tZero
Свинцово-кислотные аккумуляторные батареи электромобиля tZero- Свинцово-кислотные аккумуляторные батареи подводной лодки
Эксплуатационные характеристики
- Номинальная ёмкость, показывает количество электричества, которое может отдать данный аккумулятор. Обычно указывается в ампер-часах, и измеряется при разряде малым током (1/20 номинальной ёмкости, выраженной в А·ч)[12].
- Стартерный ток (для автомобильных аккумуляторов). Характеризует способности отдавать сильные токи при низких температурах. В большинстве случаев измеряется при −18 °C (0 °F) в течение 30 секунд. Различные методики замера отличаются (главным образом, допускаемым конечным напряжением) поэтому дают различные результаты[13].
- Резервная ёмкость (для автомобильных аккумуляторов) — характеризует время, в течение которого аккумулятор может отдавать ток 25 А до конечного напряжения 10,5 В согласно ГОСТ Р 53165-2008[14].
Эксплуатация


При эксплуатации «обслуживаемых» аккумуляторов (с открываемыми пробками на банках) на автомобиле при движении по неровной дороге неизбежно происходит просачивание электролита из-под пробок на корпус аккумулятора. Через электропроводную не высыхающую, из-за гигроскопичности, плёнку электролита происходит постепенный саморазряд аккумулятора. Во избежание глубокого саморазряда необходимо периодически нейтрализовать электролит протиранием корпуса аккумулятора, например, слабым раствором пищевой соды или разведённым в воде до консистенции жидкой сметаны хозяйственным мылом. Кроме того, особенно в жаркую погоду, происходит испарение воды из электролита; также количество воды в электролите уменьшается при перезаряде аккумулятора за счёт её электролиза. Потеря воды увеличивает плотность электролита, увеличивая напряжение на аккумуляторе. При существенной потере воды могут оголиться пластины, что одновременно увеличивает саморазряд и вызывает сульфатацию батареи. Поэтому необходимо следить за уровнем электролита и при необходимости доливать дистиллированную воду.
Эти меры вместе с проверкой автомобиля на паразитную утечку тока в его электрооборудовании и периодической подзарядкой аккумулятора могут существенно продлить срок эксплуатации аккумуляторной батареи.
Работа свинцово-кислотного аккумулятора при низких температурах
По мере снижения окружающей температуры параметры аккумулятора ухудшаются, однако, в отличие от прочих типов аккумуляторов, у свинцово-кислотных аккумуляторов это снижение относительно мало, что и обуславливает их широкое применение на транспорте. Эмпирически считается, что свинцово-кислотный аккумулятор теряет ~1 % отдаваемой ёмкости при снижении температуры на каждый градус от +20 °C. То есть, при температуре −30 °C свинцово-кислотный аккумулятор покажет примерно 50 % ёмкости.
Снижение ёмкости и токоотдачи при низких температурах обусловлено, в первую очередь, снижением скорости химических реакций (закон Аррениуса). Единственным способом повышения отдаваемой ёмкости является подогрев холодной батареи, как вариант — встроенным подогревателем (6СТ-190ТР-Н).
Разряженный аккумулятор в мороз может раздуться из-за замерзания электролита низкой плотности (близкой к 1,10 г/см3) и образования кристаллов льда, что приводит к необратимому повреждению свинцовых пластин внутри аккумулятора.
Низкие температуры электролита негативно влияют на работоспособность и зарядно-разрядные характеристики аккумулятора[15]:
- при температуре от 0 °C до −10 °C снижение зарядных и разрядных характеристик несущественно влияют на работоспособность аккумулятора;
- при температуре от −10 °C до −20 °C происходит снижение тока в стартерном режиме и ухудшение заряда;
- при температуре ниже −20 °C аккумуляторные батареи не обеспечивают надежного пуска двигателя и не способны принимать заряд от генератора.
Из-за большего внутреннего сопротивления, присущего современным аккумуляторам закрытого типа (т. н. «необслуживаемым», герметичным, герметизированным) при низких температурах по сравнению с обычными аккумуляторами (открытого типа), для них эти вопросы ещё более актуальны[16].
Для эксплуатации транспортных средств при очень низких температурах предназначены конструкции аккумулятора с внутренним электроподогревом[17].
Хранение
Свинцово-кислотные аккумуляторы следует хранить только в заряженном состоянии. При температуре ниже −20 °C подзаряд аккумуляторов должен проводиться постоянным напряжением 2,45 вольта на элемент 1 раз в год в течение 48 часов. При комнатной температуре — 1 раз в 8 месяцев постоянным напряжением 2,35 вольта на элемент в течение 6—12 часов. Хранение аккумуляторов при температуре выше 30 °C не рекомендуется.
Слой грязи, солей и плёнки электролита на поверхности корпуса аккумулятора создаёт проводник для тока между электродами и приводит к саморазряду аккумулятора, при глубоком разряде начинается сульфатация пластин с образованием более плотного сульфата, который меньше и труднее потом вступает в реакцию, чем сульфат, образующийся при нормальном рабочем разряде, что и является причиной потери ёмкости. Поэтому поверхность аккумулятора необходимо содержать в чистоте. Хранение свинцово-кислотных аккумуляторов в разряженном состоянии приводит к быстрой потере их работоспособности.
При длительном хранении аккумуляторов и разряде их большими токами (в стартерном режиме), или при уменьшении ёмкости аккумуляторов, нужно проводить контрольно-тренировочные циклы, то есть разряд-заряд токами номинальной величины.
При подготовке аккумуляторной батареи к зимнему хранению, что актуально для автомобилей, не эксплуатируемых в холодное время года, специалисты старейшей лаборатории НИИАЭ рекомендуют следующие действия:
1. Правильно и до конца зарядите аккумуляторную батарею. 2. Нанесите на положительный вывод АКБ пластичную смазку (допускается только технический вазелин, так как он имеет нейтральную кислотность, и ни в коем случае не использовать литол, солидол и тому подобное, так как они имеют небольшую кислотность и со временем такие смазки разъедают выводные клеммы АКБ), так как плёнка электролита способна абсорбировать влагу из атмосферы, что может приводить к повышенному саморазряду. 3. Хранить аккумуляторы на холоде при температуре 0—10 °C, так как при низких температурах саморазряд намного ниже. Замёрзшая вода приводит к повреждению пластин аккумулятора, поэтому нельзя хранить аккумуляторы при температуре ниже 0 °C.
В случае необходимости поездки в морозы следует перенести аккумулятор в отапливаемое помещение, и в течение 7—9 часов (например, за ночь) он придёт в пригодное для пуска двигателя состояние.
Износ свинцово-кислотных аккумуляторов
При использовании технической серной кислоты и недистиллированной воды ускоряются саморазряд, сульфатация, разрушение пластин и уменьшение ёмкости аккумуляторной батареи[18][].
Основными процессами износа свинцово-кислотных аккумуляторов являются:
- сульфатация пластин[5], заключающаяся в образовании крупных кристаллов сульфата свинца, который препятствует протеканию обратимых токообразующих процессов;
- коррозия электродов, то есть электрохимические процессы окисления и растворения материала электродов в электролите, что вызывает осыпание материала электродов;
- слабая механическая прочность или плохое сцепление активной массы с электродными решётками, что приводит к опаданию активной массы[5][19];
- оползание и осыпание активной массы положительных электродов, связанное с разрыхлением, нарушением однородности[5].
Хотя батарею, вышедшую из строя по причине физического разрушения пластин, в домашних условиях восстановить нельзя, в литературе описаны химические растворы и прочие способы, позволяющие «десульфатировать» пластины. Простой, но чреватый полным отказом аккумулятора способ предполагает использование раствора сульфата магния[5]. Раствор сульфата магния заливается в секции, после чего батарею разряжают и заряжают несколько раз. Сульфат свинца и прочие остатки химической реакции осыпаются при этом на дно банок, это может привести к замыканию элемента, поэтому обработанные банки желательно промыть и заполнить новым электролитом номинальной плотности. Это позволяет несколько продлить срок использования устройства.
Опасность
Свинцово-кислотные аккумуляторы содержат около 85 % всего используемого свинца. Это главный в мире источник загрязнения свинцом — мощным нейротоксином. В развитых странах принимаются меры по сокращению этого загрязнения, но в других старые аккумуляторы выбрасывают или перерабатывают в кустарных условиях. В результате свинец попадает в организм людей (наиболее активно — в организм детей), что приводит, среди прочего, к снижению интеллекта и нарушениям поведения. Масштаб явления таков, что может существенно влиять на экономический рост и уровень преступности. Значительный уровень свинца в крови имеют около трети детей на Земле. Это касается в первую очередь Южной Азии, Африки, Ближнего Востока и других регионов с низким уровнем жизни, но также и Латинской Америки, Восточной Европы и стран бывшего СССР. В последние десятилетия содержание свинца в крови людей, особенно детей, во многих регионах растёт из-за роста количества автомобилей и игнорирования экологических проблем[3][20][21].
Вторичная переработка

Вторичная переработка для этого вида аккумуляторов играет важную роль, так как свинец, содержащийся в аккумуляторах, является токсичным тяжёлым металлом и наносит серьёзный вред при попадании в окружающую среду. Свинец и его соли должны быть переработаны для возможности его вторичного использования.
Свинец из изношенных аккумуляторов используется для кустарной переплавки, например, при изготовлении грузил рыболовных снастей, охотничьей дроби или гирь. Кустарное извлечение свинца из аккумуляторов серьёзно вредит как окружающей среде, так и здоровью плавильщиков, поскольку свинец и его соединения с парами и дымом разносятся по всей округе[22][19].
См. также
Примечания
- ↑ Курзуков Н. И., Ягнятинский В. М. Аккумуляторные батареи. Краткий справочник // М.: ООО «Книжное издательство „За рулём“». — 2008. — 88 с., ил. ISBN 978-5-9698-0236-0. (С. 15).
- ↑ 1 2 3 RUVDS, 15/07, 2021.
- ↑ 1 2 Токсичная правда. Отравление свинцом поражает детей почти во всем мире. Радио «Свобода» (3 августа 2020). Архивировано 30 мая 2023 года.
- ↑ Bertrand Gille Histoire des techniques. — Gallimard, coll. «La Pléiade», 1978, ISBN 978-2070108817.
- ↑ 1 2 3 4 5 6 7 8 Свинцовые аккумуляторы. Эксплуатация: Правда и вымыслы. Архивная копия от 25 октября 2011 на Wayback Machine[]
- ↑ Н. Ламтев. Самодельные аккумуляторы. Москва: Государственное издательство по вопросам радио, 1936 год. Дата обращения: 21 октября 2011. Архивировано 5 ноября 2014 года.
- ↑ "Как отрыть автомобильный аккумулятор: делаем батарею обслуживаемой". AkkumulyatorAvto.ru. 2017-08-02. Архивировано 12 августа 2018. Дата обращения: 12 августа 2018.
- ↑ Удельная электропроводность х водных растворов серной кислоты и температурный коэффициент аt. chemport.ru. Дата обращения: 1 июля 2018. Архивировано 1 июля 2018 года.
- ↑ Американцы облегчили и уменьшили аккумуляторы Архивная копия от 9 января 2007 на Wayback Machine
- ↑ Аккумуляторы для бесперебойного питания. Статьи компании «ООО Новая система». aegmsk.ru. Дата обращения: 12 августа 2018. Архивировано из оригинала 12 августа 2018 года.
- ↑ 1 2 Свинцовый кислотный аккумулятор. Устройство и принцип действия аккумулятора. www.eti.su. Дата обращения: 1 июля 2018. Архивировано 1 июля 2018 года.
- ↑ ГОСТ 26881-86 Методика проверки свинцовых аккумуляторов. Дата обращения: 15 октября 2011. Архивировано 6 ноября 2014 года.
- ↑ Краткий аналитический обзор существующих способов оценки ёмкости ХИТ и приборов, реализующих эти способы. Дата обращения: 21 октября 2011. Архивировано из оригинала 4 марта 2016 года.
- ↑ ГОСТ Р 53165-2008, 2009.
- ↑ Руководство, 1983, с. 70.
- ↑ Железнодорожный транспорт. — 2011. № 12. — c.35. Дата обращения: 13 декабря 2015. Архивировано из оригинала 22 декабря 2015 года.
- ↑ Руководство, 1983, с. 21—23.
- ↑ Свинцовые аккумуляторы: правда и вымыслы (по версии Alex_Soroka). Электротранспорт. Дата обращения: 27 октября 2021. Архивировано 27 октября 2021 года.
- ↑ 1 2 Кочуров, 2009.
- ↑ A third of the world’s children poisoned by lead, new groundbreaking analysis says. UNICEF (29 июля 2020). Архивировано 4 июня 2023 года.
- ↑ The Toxic Truth Report. Pure Earth (2020). Архивировано 5 июня 2023 года.
- ↑ Отравление свинцом | ProfMedik Медицинский Портал. profmedik.ru (22 февраля 2016). Дата обращения: 4 февраля 2017. Архивировано 5 февраля 2017 года.
Литература
- Каштанов В. П., Титов В. В., Усков А. Ф. и др. Свинцовые стартерные аккумуляторные батареи. Руководство. — М.: Воениздат, 1983. — С. 21—23, 176. — 148 с.
- ГОСТ 15596-82 : Источники тока химические. Термины и определения // Электротехника. Термины и определения : Ч. 2 : сб. стандартов. — М. : Стандартинформ, 2005.
- ГОСТ Р 53165-2008 : Батареи аккумуляторные свинцовые стартерные для автотракторной техники. Общие технические условия : (МЭК 60095-1:2006) = Lead-acid storage starter batteries for motor-tractors. General specifications. — М. : Стандартинформ, 2009.
- Кочуров, А. А. О противоречиях в теории работы свинцового кислотного аккумулятора : [арх. 3 марта 2017] / А. А. Кочуров (канд. техн. наук, проф.) ; Рязанский военный автомобильный институт // Материалы 65-й Международной научно-технической конференции Ассоциации автомобильных инженеров (ААИ) «Приоритеты развития отечественного автотракторостроения и подготовки инженерных и научных кадров» Международного научного симпозиума «Автотракторостроение–2009» : [арх. 16 октября 2016] / Сб. подг. оргком-том Междунар. научн. симпоз. «Автотракторостроение–2009» под общ. ред. проф., докт. техн. наук С. В. Бахмутова. — М. : МАМИ, 2009. — Кн. 1. — С. 169–179. — 462 с. — ISBN 978-5-94099-077-2.
- Гумелёв, В. Ю. Характер разрушения положительных электродов свинцовых аккумуляторов : [арх. 24 октября 2015] / В. Ю. Гумелёв, А. А. Кочуров // Исследования в области естественных наук : журн. — 2013. — № 3.
Ссылки
- Явруян, Х. К. Способ приведения в рабочее состояние кислотной свинцовой аккумуляторной батареи : SU 1173468 : Авторское свидетельство СССР / Х. К. Явруян, Ф.И. Куков, В. Г. Чернов. — Госкомитет СССР по делам изобретений и открытий, 1985.
- Явруян, Х. К. О рациональном режиме работы кислотных свинцовых аккумуляторных батарей [Текст : Автореферат дис., представленной на соискание ученой степени кандидата технических наук] : автореф. дисс. … канд. техн. наук / М-во высш. и сред. спец. образования РСФСР. Горьк. политехн. ин-т им. А. А. Жданова. — Горький, 1960. — 9 с.
- Первый отечественный автомобильный AGM аккумулятор — AKOM ULTIMATUM. Большой безжалостный тест : [арх. 15 июля 2021] // Блог компании RUVDS.com. — 2021. — 15 июля.
- Восстановительный заряд автомобильных AGM аккумуляторов после глубокого разряда на примере Topla Stop&Go AG60 : [арх. 24 июля 2021] // Блог компании RUVDS.com. — 2021. — 23 июля.
- Почему свинцово-кислотные аккумуляторы так сложно заряжать? : [арх. 31 августа 2021] // Блог компании RUVDS.com. — 2021. — 30 августа.
- Discover How Car Batteries Work : [англ.] : видео. — Science, 2010.
- Свинцово кислотные АКБ : Достоинства и недостатки кислотных аккумуляторных батарей : видео. — Автопортал, 2020.
- Аккумуляторы. Мифы и реальность : [арх. 1 июня 2022] // Издательский дом «Софт-Пресс» (Украина). — 2016. — 1 сентября.





















