Свободные радикалы

Свободные радикалы в химии — частицы, содержащие один или несколько неспаренных электронов на внешней электронной оболочке. Свободные радикалы бывают твёрдыми, жидкими и газообразными веществами и могут существовать от очень короткого (доли секунды) до очень долгого времени (до нескольких лет). Радикалы могут быть не только нейтральными, но и ионными (ион-радикалы), а также иметь более одного неспаренного электрона (как, например, у бирадикалов). Свободные радикалы обладают парамагнитными свойствами и являются очень реакционноспособными частицами[1].
История открытия
Существование свободных радикалов постулировалось ещё в XIX веке. В 1849 году английский химик Эдуард Франкленд нагреванием иодэтана с цинком получил бутан, полагая, что это этильный радикал. Подобную ошибку допустил и немецкий химик Герман Кольбе, приняв этан за метильный радикал[2].

Впервые свободный радикал в растворе обнаружил американский химик Мозес Гомберг. В 1900 году он открыл трифенилметильный радикал, получив его действием серебра на трифенилметилхлорид. Из-за присутствия этого радикала раствор был окрашен в жёлтый цвет, а затем из раствора выпали белые кристаллы димера этого радикала[2].
В 1901 году был получен порфирексид, свободный радикал нитроксильной структуры, однако получившие его О. Пилоти и Б. Шверин не идентифицировали его как радикал[3].
В 1929 году немецкий химик Фридрих Панет идентифицировал метильный и этильный радикалы. В одном из экспериментов он разлагал тетраметилсвинец в токе водорода в термостойкой стеклянной трубке. При этом образовывались метильные радикалы, которые увлекались током водорода дальше по трубке, и металлический свинец, который выпадал на внутреннем диаметре в виде зеркала. Через 30 см от места разложения тетраметилсвинца внутри трубки находилось другое, заранее нанесённое свинцовое зеркало. Пролетающие метильные радикалы реагировали с этим свинцом, снова образуя тетраметилсвинец, который конденсировался в конце установки. Этот же эксперимент позволил благодаря варьированию расстояния между местом разложения и свинцовым зеркалом, а также по скорости тока водорода оценить время жизни радикалов. В условиях опыта (при 1—2 мм рт. ст.) оно составило около 0,0084 секунд[4].
В 1930 году Г. А. Разуваев и В. Н. Ипатьев изучали фотолиз диметилртути в четырёххлористом углероде и установили, что в ходе процесса образуются такие продукты, которые могут образоваться в только в ходе гомолитического распада связи ртуть — углерод. Это послужило доказательством того, что свободные радикалы могут существовать в растворах[4].
Строение и стабильность
Свободные радикалы делят на σ-электронные и π-электронные. У σ-электронных радикалов неспаренный электрон расположен на σ-орбитали. Как следствие, атом с неспаренным электроном сохраняет свою гибридизацию, а радикал имеет практически то же строение, что и исходная молекула. К σ-электронным радикалам относятся фенильный (C6H5•), винильный (CH2=CH•) и формильный (HC•=O) радикалы, а также карбоксильный (CO2-•) и пиридильный (C5H5N+•) ион-радикалы. В таких радикалах неспаренный электрон слабо делокализуется. Например, в фенильном радикале спиновая плотность на радикальном центре составляет 0,9918, а существенное взаимодействие наблюдается лишь с орто-протонами[1][5].
У π-электронных радикалов неспаренный электрон расположен на p-орбитали, вследствие чего радикальный центр имеет sp2-гибридизацию. Окружающие атомы при этом расположены в узловой плоскости этой орбитали, а радикал имеет вид плоского треугольника или низкой пирамиды с очень малым энергетическим барьером инверсии. К π-электронным радикалам относятся, например, алкильные, аллильные и бензильные радикалы. Из них метильный радикал является плоским, а радикалы CF3• и C(CH3)3• представляют собой низкие пирамиды. Это подтверждается тем, что, например трифторметильный радикал имеет ненулевой дипольный момент (0,43 Д)[1].
Стабильность радикалов рассматривают с термодинамических и кинетических позиций, хотя в большинстве случаев оба вида факторов действуют одновременно. Термодинамическая стабильность радикалов связана с тем, насколько эффективно делокализован неспаренный электрон, поскольку делокализация снижает энтальпию образования свободного радикала. Оценить энтальпию образования радикала можно по энергии диссоциации связи, разрыв которой приводит к образованию этого радикала[6].
Как следствие, в ряду алифатических радикалов термодинамическая стабильность изменяется следующим образом[6]:
Кинетическая стабильность связана с реакционной способностью радикала по отношению к другим молекулам и радикалам. В первую очередь влияние на кинетическую стабильность оказывает наличие объёмных заместителей около реакционного центра. Если стерические препятствия для подхода реагента к радикалу достаточно велики, то такой радикал может существовать в свободном виде достаточно долгое время. Кинетически стабильные радикалы также называют долгоживущими[6].
Короткоживущие свободные радикалы
К короткоживущим относятся те свободные радикалы, у которых неспаренный электрон является локализованным, то есть у которых отсутствуют механизмы стабилизации за счёт участия соседних орбиталей или экранирования объёмными заместителями. Короткоживущими являются, например, радикалы NH2·, CH3·, OH·, SiH3· и др. Такие радикалы приходится стабилизировать либо при помощи сильного охлаждения (жидкими гелием, водородом, азотом или аргоном), либо за счёт эффекта клетки, когда свободные радикалы при низкой температуре находятся в окружении молекул застеклованного растворителя[1].
Короткоживущие свободные радикалы генерируют воздействуя на вещество различными физическими или химическими способами. Типичным примером является генерирование метильного радикала при электролизе ацетата натрия в ходе реакции Кольбе[7].
Также короткоживущие радикалы генерируют фотолизом. При этом энергия кванта, поглощаемого веществом, должна превышать энергию диссоциации одной из его химических связей[7].
Некоторые органические соединения с низкой энергией диссоциации соответствующей связи дают свободные радикалы при пиролизе. Так, нагревание органических пероксидов (перекиси бензоила, трет-бутилгидропероксида, кумилпероксида, трет-бутилпероксида) приводит к гомолитическому разрыву связи O-O и образованию двух радикалов[7].
Долгоживущие свободные радикалы
Долгоживущие свободные радикалы отличаются от короткоживущих тем, что неспаренный электрон в них сильно делокализован, а реакционный центр окружён объёмными заместителями, которые создают пространственные затруднения и понижают реакционную способность этого центра[7]. Получают их различными химическими реакциями, в том числе реакциями одноэлектронного переноса и реакциями без затрагивания радикального центра[3].
Типичными представителями этого класса свободных радикалов являются арилметильные радикалы. Некоторые из них являются устойчивыми при комнатной температуре окрашенными кристаллическими или аморфными веществами, содержащими около 6·1023 спин/моль неспаренных электронов. Например, так называемые инертные радикалы (C6Cl5)2C•Cl, (C6Cl5)3C•, (C6Cl5)2C•C6H4OH имеют оранжево-красный цвет и плавятся при высокой температуре[7].
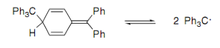
В растворах эти радикалы существуют в равновесии с молекулами-димерами. На положение этого равновесия, то есть на соотношение радикала и димера, влияет сольватация, а также электронные и пространственные эффекты[7]. Первоначально считалось, что димеры имеют структуру гексаарилэтанов, но позже было показано, что они имеют хиноидную структуру[8].
| Радикал | Степень диссоциации, % | Радикал | Степень диссоциации, % |
|---|---|---|---|
| Ph3C• | 2 | трет-Bu(п-PhC6H4)2C• | 74 |
| (п-PhC6H4)Ph2C• | 15 | (Ph2C=CH)Ph2C• | 80 |
| (β-C10H7)3C• | 24 | (п-PhC6H4)3C• | 100 |
| (α-C10H7)Ph2C• | 60 | (Ph3C)Ph2C• | 100 |
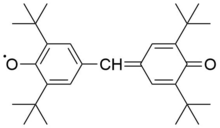
Ароксильные радикалы также относятся к долгоживущим, хотя они быстро реагируют с кислородом, поэтому работа с ними требует инертной атмосферы или вакуума. Они образуются как промежуточные соединения при окислении фенолов. В чистом виде выделены гальвиноксильный радикал с т. пл. 158 °С и индофеноксильный радикал с т. пл. 136 °С[7].
 |  |

Существует ряд долгоживущих радикалов, у которых радикальный центр находится на атоме азота. Так, аминильные радикалы, устойчивые при 25 °С, получают окислением вторичных аминов. Особенной устойчивостью обладают вердазильные радикалы, являющиеся одними из самых стабильных органических парамагнетиков. Их период полуразложения на воздухе при комнатной температуре может составлять многие годы[7].
Нитроксильные радикалы по строению схожи с оксидами аминов. Радикальный центр в них находится на атоме кислорода, соединённом с атомом азота. Некоторые нитроксильные радикалы очень устойчивы даже несмотря на то, что неспаренный электрон в них не подвергается делокализации. Известным примером такого устойчивого радикала является тёмно-красный 2,2,6,6-тетраметилпиперидин-1-оксил (TEMPO) с т. пл. 38 °С. Существуют, однако, и иные структуры, где делокализация неспаренного электрона хорошо выражена, а реакционный центр окружён объёмными заместителями[3].
Иминоксильные радикалы имеют общую формулу RR’C=NO•. Благодаря наличию двойной связи они могут существовать в виде цис- и транс-изомеров[3].
Химические свойства
Поскольку у свободных радикалов есть неспаренный электрон, они проявляют характерные химические свойства. Так, они вступают в реакции с другими частицами, содержащими неспаренный электрон: со свободными радикалами (в том числе рекомбинируют сами с собой), металлами и молекулярным кислородом[9].
Также свободные радикалы способны реагировать с соединениями, которые легко диссоциируют на атомы[9].
Один радикал может оторвать атом водорода от другого радикала: при этом происходит диспропорционирование (образуется одно насыщенное и одно ненасыщенное соединение), а общее число радикалов в системе уменьшается[9].
Выделяют также реакции с переносом радикального центра, в которых неспаренный электрон в результате отрыва водорода или присоединения радикала по двойной связи оказывается на другой частице[9].
Существуют и реакции, обратные присоединению, когда радикалы распадаются с разрывом связи в β-положении. Такая фрагментация особенно характерна для алкоксильных радикалов, которые при наличии нескольких путей распада предпочитают тот, при котором образуется более устойчивый алкильный радикал[9].
Для свободных радикалов характерны реакции перегруппировки, однако в случае радикалов атомы водорода и алкильные группы мигрируют редко (в отличие от перегруппировок карбокатионов). Гораздо чаще встречается миграция фенильной группы или атомов галогена[9].
Обнаружение и анализ
Свободные радикалы обнаруживают благодаря их парамагнитным свойствам. Преимущественно для этого используется метод электронного парамагнитного резонанса (ЭПР). Спектры ЭПР позволяют не только обнаружить свободные радикалы, но и получить информацию об их строении и степени делокализации неспаренного электрона. Для этого используют два параметра: g-фактор и константу сверхтонкого расщепления. Первый из них является аналогом химического сдвига в спектроскопии ЯМР[10].
Сверхтонкое расщепление возникает из-за взаимодействия неспаренного электрона с магнитными ядрами радикала. Если электрон взаимодействует с ядром, имеющим спиновое число I, то в результате расщепления возникает 2I+1 линий. Если таких ядер несколько, например, n, то число линий становится равным 2nI+1. У протона спиновое число равно +½, поэтому n эквивалентных протонов расщепляют линию в спектре ЭПР на n+1 линий. Относительная интенсивность этих линий соответствует биномиальным коэффициентам[10].
Спектр трифенилметильного радикала ещё более сложен, поскольку там неспаренный электрон взаимодействует с 6 эквивалентными протонами в орто-положении, 6 эквивалентными протонами в мета-положении и 3 эквивалентными протонами в пара-положении. В этом случае число линий от каждой группы эквивалентных протонов нужно перемножать, поэтому суммарное число линий в ЭПР-спектре этого катиона равно 7·7·4 = 196. Спектры сложных радикалов расшифровывают путём расчёта теоретических спектров и сравнения их с экспериментальными[10].

Концентрацию свободных радикалов в образце определяют, записывая одновременно спектр эталона и спектр исследуемого образца. Затем интенсивности сигналов сравнивают. В качестве эталона часто используют дифенилпикрилгидразильный радикал Ph2N-N•-C6H2(NO2)3. Этот же радикал, имеющий тёмно-фиолетовую окраску, позволяет следить за образованием и расходованием радикалов в динамике, поскольку при его взаимодействии с другими радикалами окраска изменяется на жёлтую либо исчезает[10].
Сложные свободные радикалы исследуют методами двойного электрон-ядерного резонанса (ДЭЯР) и химической поляризации ядер. Если концентрация свободного радикала в растворе достаточна, его можно изучить методом ЯМР[7]
Применение
Долгоживущие свободные радикалы находят применение в качестве стабилизаторов, предотвращающих процессы окисления и полимеризации: в частности, ими стабилизируют акрилонитрил, винилацетат, винилиденхлорид, стирол, фурфурол, жиры и масла. В молекулярной биологии они используются в качестве спиновых меток. Их также используют в производстве фотоматериалов, полимерных покрытий, в приборостроении, геофизике и дефектоскопии[3].
Короткоживущие радикалы встречаются в природе как промежуточные частицы в различных химических реакциях, например радикальном галогенировании[3].
Свободные радикалы также образуются в организме человека в ходе обычной жизнедеятельности: при биосинтезе простагландинов, в работе митохондрий и фагоцитов. С образованием в организме радикалов связывают процессы старения[3].
См. также
- Цепная реакция (химия)
- Реактивные формы кислорода
- Окислительный стресс
Примечания
- ↑ 1 2 3 4 Химическая энциклопедия, 1995, с. 154.
- ↑ 1 2 Берберова, 2000, с. 39–40.
- ↑ 1 2 3 4 5 6 7 Химическая энциклопедия, 1995, с. 156.
- ↑ 1 2 Берберова, 2000, с. 41.
- ↑ Днепровский, Темникова, 1991, с. 178–181.
- ↑ 1 2 3 Днепровский, Темникова, 1991, с. 181–183.
- ↑ 1 2 3 4 5 6 7 8 9 10 Химическая энциклопедия, 1995, с. 155.
- ↑ Днепровский, Темникова, 1991, с. 180.
- ↑ 1 2 3 4 5 6 Днепровский, Темникова, 1991, с. 189–191.
- ↑ 1 2 3 4 Днепровский, Темникова, 1991, с. 175–177.
Литература
- Розанцев Э. Г. Радикалы свободные // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные — Трипсин. — С. 154–157. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Днепровский А. С., Темникова Т. И. Теоретические основы органической химии. — 2-е издание. — Л. : Химия, 1991. — С. 175–198. — ISBN 5-7245-0206-2.
- Берберова Н. Т. Из жизни свободных радикалов // Соросовский образовательный журнал. — 2000. — Т. 6, № 5. — С. 39–44.








![{\displaystyle {\mathsf {CH_{3}COO^{-}{\xrightarrow[{}]{-e^{-}}}CH_{3}COO^{\cdot }{\xrightarrow[{}]{-CO_{2}}}{CH_{3}}^{\cdot }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b3e525f52aaed6657de44d0bb8187b72d29252a)
![{\displaystyle {\mathsf {Ph_{2}Hg{\xrightarrow[{}]{hv}}Ph^{\cdot }+PhHg^{\cdot }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/66a0e0739f5323636757bf8941fd6dcb6c05b481)
![{\displaystyle {\mathsf {(CH_{3})_{3}COOC(CH_{3})_{3}{\xrightarrow[{}]{t}}2(CH_{3})_{3}CO^{\cdot }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/14e59319db3dee6e1332c591805df71eb8d42b2a)




















