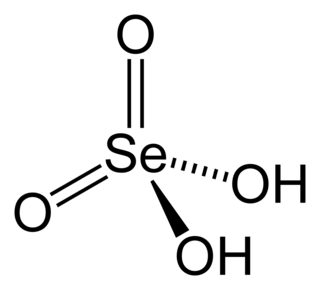
Селенистая кислота
| Селенистая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | селенистая кислота | ||
| Хим. формула | H2SeO3 | ||
| Физические свойства | |||
| Состояние | твёрдое тело | ||
| Молярная масса | 128,97 г/моль | ||
| Плотность | 3,004 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • воспламенения | не воспламеняется °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 2,46 | ||
| Растворимость | |||
| • в воде | смешивается | ||
| • в воде 20 °С | 167 г/100 мл | ||
| • в воде 90 °С | 385 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 7783-00-8 | ||
| PubChem | 1091 и 18762062 | ||
| Рег. номер EINECS | 231-974-7 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 26642 | ||
| ChemSpider | 1060 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Селе́нистая кислота́ — неорганическое химическое соединение селена, кислота. Химическая формула H2SeO3.
Является аналогом сернистой и теллуристой кислот.
Селенистая кислота — одна из двух основных оксикислот селена (вторая из них — селеновая кислота H2SeO4). Как и многие другие растворимые соединения селена, она очень сильно ядовита.[1]
Физические свойства
Большие призматические кристаллы.[1] Гигроскопична, расплывается во влажном воздухе.[1][2] Хорошо растворима в воде и этаноле.[1][2] Неустойчивая кислота, при нагревании выше 70 °C плавится с разложением на воду и диоксид селена SeO2.[1][3]
Химические свойства
Весьма слабая кислота. В водных растворах диссоциирует:[1][4]
- , K1 = 2,4•10-3
- , K2 = 4,8•10-9
Проявляет окислительно-восстановительную двойственность. Обыкновенно восстанавливается до красного селена, окисляется до селеновой кислоты. Например, реагирует с концентрированными растворами галогеноводородных кислот (кроме фтороводородной), окисляя их до галогенов:
В результате этой реакции элементарный селен выпадает в осадок.
Ввиду своей относительно сильной окислительной активности, может иметь розоватый цвет ввиду окисления частиц пыли и восстановления дкрасного селена.
При реакциях с металлами (например, магнием) даже в разбавленном растворе выделяет и водород, и восстанавливается:
Сама селенистая кислота может быть окислена сильными окислителями (хлор и бром в щелочной среде, озон в сильнокислой среде, пероксид водорода) до селеновой кислоты:[1]
В результате электролиза водного раствора на катоде выделяется водород, а на аноде — селеновая кислота:
Получение
Селенистая кислота может быть получена растворением оксида селена(IV) SeO2 в воде:
Также может быть получена растворением селена в азотной кислоте, где диоксид селена сразу прореагирует с водой:[1]
Применение
Селенистую кислоту обычно применяют для травления металлов, например меди или магния, для оксидирования стали в процессе холодного воронения стали, в основном деталей огнестрельного оружия.[5]
Применяется для получения глиоксаля окислением ацетальдегида.
Основной компонент в реактиве на некоторые наркотические вещества[6].
Используется как источник селена при его дефиците.
Также из селенистой кислоты окислением либо электролизом получают селеновую кислоту H2SeO4.
Токсичность
Селенистая кислота очень сильно ядовита. При попадании на кожу вызывает раздражение и химические ожоги. По данным единичных отчётов об отравлениях, смертельная доза составляет от 10 до 20 мг/кг массы тела.[7]
См. также
Примечания
- ↑ 1 2 3 4 5 6 7 8 Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — Москва, 1974.
- ↑ 1 2 PubChem Selenious Acid (англ.). pubchem.ncbi.nlm.nih.gov. Дата обращения: 27 сентября 2024.
- ↑ PubChem Selenious Acid (англ.). pubchem.ncbi.nlm.nih.gov. Дата обращения: 27 сентября 2024.
- ↑ PubChem Selenious Acid (англ.). pubchem.ncbi.nlm.nih.gov. Дата обращения: 27 сентября 2024.
- ↑ Agrawal, Sonali Selenious Acid | Properties, Uses & Side effects (амер. англ.). Macsen Labs (24 ноября 2021). Дата обращения: 27 сентября 2024.
- ↑ Colour Test Reagents-Kits for Preliminary Identification of Drugs of Abuse. National Institute of Justice (1 июля 2000). Дата обращения: 26 января 2012. Архивировано 1 апреля 2010 года.
- ↑ Hadrup, Niels; Ravn-Haren, Gitte. Acute human toxicity and mortality after selenium ingestion: A review (англ.) // Journal of Trace Elements in Medicine and Biology. — 2020.








![{\displaystyle {\ce {H2SeO3 + H2O2 ->[t] H2SeO4 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fd27e2d147f8f9a9fd67b480965965322aefb0c)
![{\displaystyle {\ce {H2SeO3 + H2O ->[e^-] H2SeO4 + H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81631d672ebfdf7d653570a318a6c9ae3266316f)