Спектра́льная ли́ния — узкий участок энергетического спектра, где интенсивность излучения усилена либо ослаблена по сравнению с соседними областями спектра. В первом случае линия называется эмиссионной линией, во втором — линией поглощения. Положение линии в электромагнитном спектре обычно задаётся длиной волны, частотой или энергией фотона. Кроме электромагнитного спектра, спектральные линии могут возникать в спектрах энергии частиц, в спектрах звуковых колебаний и вообще любых волновых процессов. Ниже, если нет специальных оговорок, имеются в виду электромагнитные спектры.
Эле́ктроотрица́тельность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов притягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов и сильных окислителей, а низкая — у активных металлов.
Экситон Ванье — Мотта — экситон, радиус которого значительно превышает характерный период решётки кристалла.
Лэ́мбовский сдвиг — различие между энергиями стационарных состояний  и
и  атома водорода и водородоподобных ионов, обусловленное взаимодействием атома с нулевыми флуктуациями электромагнитного поля. Экспериментальное изучение смещения уровней атома водорода и водородоподобных ионов представляет фундаментальный интерес для проверки теоретических основ квантовой электродинамики.
атома водорода и водородоподобных ионов, обусловленное взаимодействием атома с нулевыми флуктуациями электромагнитного поля. Экспериментальное изучение смещения уровней атома водорода и водородоподобных ионов представляет фундаментальный интерес для проверки теоретических основ квантовой электродинамики.

Йоха́ннес Ро́берт Ри́дберг — шведский физик. Наиболее известен открытием в 1888 году формулы Ридберга, которая описывает длины волн спектральных линий излучения атомов водорода.
А́том водоро́да — физико-химическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра, как правило, входит протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон образует электронную оболочку; наибольшая вероятность обнаружения электрона в единичном объёме наблюдается для центра атома. Интегрирование по сферическому слою показывает, что наибольшая вероятность обнаружения электрона в единичном слое соответствует среднему радиусу, равному боровскому радиусу  ангстрема.
ангстрема.

Зако́н Мо́зли — закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером. Экспериментально установлен английским физиком Генри Мозли в 1913 году.

Бо́ровская моде́ль а́тома — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Эрнестом Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка:  .
.

Се́рия Ла́ймана — серия спектральных линий в спектре атома водорода. Эта серия образуется при переходах электронов с возбуждённых энергетических уровней на первый невозбуждённый уровень основного состояния атома водорода в спектре излучения и с первого уровня на все остальные в спектре поглощении.

Спектра́льные се́рии водо́рода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее хорошо изучены. Они хорошо подчиняются формуле Ридберга:

- где R = 109 677 см−1 — постоянная Ридберга для водорода,
- n′ — основной уровень серии, n — натуральное число больше n′.
Се́рия Ба́льмера — одна из спектральных серий атома водорода, наблюдающаяся для переходов между вторым энергетическим уровнем атома и вышележащими уровнями. В отличие от ультрафиолетовой серии Лаймана, связанной с переходами на основной уровень, четыре первые линии серии Бальмера лежат в видимой области спектра.

Се́рия Па́шена — спектральная серия в спектре атома водорода, названная в честь австрийского физика Фридриха Пашена, открывшего в 1908 году эту серию, ранее предсказанную Вальтером Ритцем на основании его комбинационного принципа. Данная серия образуется при переходах электронов с возбуждённых энергетических уровней на третий в спектре излучения и с третьего уровня на все вышележащие уровни при поглощении. Переход с четвёртого энергетического уровня на третий обозначается греческой буквой α, с 5-го на 3-й — β и т. д. Для обозначения самой серии используется латинская буква P. Таким образом, полное обозначение спектральной линии, возникающей при переходе электрона с четвёртого уровня на третий — Pα.

Се́рия Брэ́ккета — спектральная серия в спектре атома водорода, названная в честь американского физика Фредерика Брэккета, открывшего эту серию в 1922 году. Данная серия образуется при переходах электронов с возбуждённых энергетических уровней на четвёртый в спектре излучения и с четвёртого уровня на все вышележащие уровни при поглощении. Переход с пятого энергетического уровня на четвёртый обозначается греческой буквой α, с 6-го на 4-й — β и т. д. Для обозначения самой серии используется латинская буква B. Таким образом, полное обозначение спектральной линии, возникающей при переходе электрона с пятого уровня на четвёртый — Bα.

Се́рия Пфу́нда — спектральная серия в спектре атома водорода, названная в честь американского физика Августа Пфунда, открывшего эту серию в 1924 году. Данная серия образуется при переходах электронов с возбуждённых энергетических уровней на пятый в спектре излучения и с пятого уровня на все вышележащие уровни при поглощении. Переход с шестого энергетического уровня на пятый обозначается греческой буквой α, с 7-го на 5-й — β и т. д. Для обозначения самой серии используются латинские буквы Pf. Таким образом, полное обозначение спектральной линии, возникающей при переходе электрона с шестого уровня на пятый — Pfα.
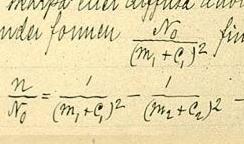
Фо́рмула Ри́дберга — эмпирическая формула, описывающая длины волн в спектрах излучения атомов химических элементов. Предложена шведским учёным Йоханнесом Ридбергом и представлена 5 ноября 1888 года.

Изото́пы водоро́да — разновидности атомов химического элемента водорода, имеющие разное количество нейтронов в ядре. На данный момент известны 7 обычных изотопов водорода, а также один экзотический атом водород-4.1.
Серия Пикеринга или серия Пикеринга-Фаулера — серия из трёх спектральных линий однократно ионизованного гелия, обычно обнаруживаемая среди линий поглощения в спектрах горячих звёзд типа звёзд Вольфа — Райе. Название серия получила в честь Эдварда Чарльза Пикеринга и Альфреда Фаулера. Линии возникают при переходах с более высокого уровня энергии электрона на уровень с главным квантовым числом n = 4. Линии соответствуют длинам волн
Спектроскопия многократно ионизованных атомов - этот раздел спектроскопии имеет дело с излучением атомов, лишенных нескольких электронов. МИА наблюдаются в очень горячей плазме или в экспериментах на ускорителях. Самые низковозбужденные электронные оболочки МИА обычно распадаются в стабильные основные состояния с испусканием фотонов в вакуумном ультрафиолете и мягкой рентгеновской области спектра.