Система рестрикции-модификации

Система рестрикции-модификации — ферментативная система бактерий, разрушающая попавшую в клетку чужеродную ДНК. Основная её функция — защита клетки от чужеродного генетического материала, например, бактериофагов и плазмид. Для компонентов системы характерны два типа активности — метилтрансферазная (метилазная) и эндонуклеазная. За каждую из них могут отвечать как отдельные белки, так и один белок, сочетающий в себе обе функции.[1]
Система рестрикции-модификации (СР-М) специфична по отношению к определённым последовательностям нуклеотидов в ДНК, называемых сайтами рестрикции. Если определённые нуклеотиды в последовательности не метилированы, эндонуклеаза рестрикции вносит в ДНК двуцепочечный разрыв (часто — со смещением на несколько нуклеотидов между цепями), при этом биологическая роль молекулы ДНК нарушается. В случае, когда метилирована только одна из цепей ДНК, расщепления не происходит, вместо этого метилтрансфераза добавляет метильные группы к нуклеотидам второй цепи. Подобная специфичность СР-М позволяет бактериям проводить селективное расщепление чужеродной ДНК, не затрагивая собственную. В норме вся ДНК в бактериальной клетке либо полностью метилирована, либо полностью метилирована только по одной цепи (сразу после репликации). Напротив, чужеродная ДНК не метилирована и подвергается гидролизу.[1]
История открытия
Системы рестрикции-модификации были открыты в результате изучения молекулярных механизмов явления, называемого «рестрикция, контролируемая хозяином» (англ. host-controlled restriction). Суть явления заключается в том, что бактериофаги, выделенные из клеток одного штамма бактерий, очень плохо размножаются в другом. При инфицировании вирусными частицами, выделенными из второго штамма, клеток первого опять наблюдается подавление размножения фага, в то время как во втором штамме они репродуцируются нормально. Таким образом, у бактерий наблюдается система подавления размножения бактериофагов. Вирусы, которые все же смогли её преодолеть, приобретают устойчивость к действию этой системы. С. Лурия и M.L. Human в своей статье 1952 года[2] писали:
Анализируя соотношение между определёнными фагами и определёнными мутантами их бактерий-хозяев, мы столкнулись с новым феноменом: генотип хозяина, в котором размножается вирус, влияет на фенотип новых вирусов. Фенотипические изменения подавляют способность вируса размножаться в определённых штаммах. Это непостоянное изменение, один успешный цикл размножения в подходящем хозяине возвращает вирус в исходную форму.
Оригинальный текст (англ.)In analyzing the relation between certain phages and certain mutants of their bacterial hosts, we have encountered a novel situation: the genotype of the host in which a virus reproduces affects the phenotype of the new virus. The phenotypic change suppresses the ability of the virus to reproduce in certain hosts but not in others. It is a transient change, in the sense that one cycle of growth in a suitable host returns the virus to its original form.

Впоследствии было показано, что бактериофаги, выделенные из разных штаммов, имеют одинаковый генотип, но разную картину метилирования ДНК, соответствующую специфичности СР-М данного штамма.[3]
В 1978 году Вернер Арбер, Даниел Натанс и Хамилтон Смит были удостоены Нобелевской премии по физиологии и медицине «За обнаружение рестрикционных ферментов и их применение в молекулярной генетике».
Номенклатура
Ферменты СР-М именуются в соответствии с системой, предложенной в 1973 году Смитом и Натансом.[4] Название фермента начинается с трёхбуквенного акронима, в котором первая буква совпадает с первой буквой названия рода, а остальные — с первыми двумя буквами вида организма, в котором данный фермент был обнаружен. Акроним пишется курсивом. Дополнительные буквы служат для обозначения конкретного штамма или серотипа. Римские цифры присваиваются в порядке обнаружения ферментов данного типа у конкретного организма. Дополнительные буквы и цифры курсивом не выделяются. Например:
- BsuI — фермент является компонентом первой СР-М, обнаруженной у Bacillus subtilis
- EcoRV — компонент пятой СР-М, охарактеризованной у Escherichia coli штамма RY13
В печатных источниках наблюдаются значительные различия в написании названий одних и тех же ферментов (в плане курсивного выделения и наличия пробелов). В 2003 году большая группа учёных предложила систематизировать классификацию и номенклатуру рестриктаз и метилтрансфераз.[5] В частности, предлагается отказаться от использования курсива, всё название должно писаться без пробелов. Рекомендуется избегать названий «рестриктаза» и «метилаза», употребляя вместо этого «эндонуклеаза рестрикции» и «метилтрансфераза»; тип ферментативной активности указывать буквами R (эндонуклеазная) и M (метилтрансферазная) перед акронимом — M.EcoRI и R.EcoRI.
Ферментативная активность
Эндонуклеазная
Эндонуклеазы рестрикции вносят разрывы в обе цепи ДНК, расщепляя её на две части. В зависимости от специфичности разрезания ДНК, образуются продукты, имеющие разное строение концов (см. рисунок).
- Липкие концы имеют выступающие одноцепочечные участки. При этом выступающие участки двух образующихся фрагментов комплементарны друг другу. Ввиду продольной асимметричности молекулы ДНК, концы её цепей неравнозначны. Они обозначаются 3' и 5' в соответствии с нумерацией атомов в 2-R-дезоксирибофуранозиде.
- могут образовываться липкие концы с 5'-выступающими нуклеотидами (такие продукты образует эндонуклеаза рестрикции BamHI).
- и 3'-выступающие липкие концы, когда неспаренные нуклеотиды заканчиваются 3'-концом (такие продукты образует эндонуклеаза рестрикции AatII).
- Тупые концы образуются, в случае, когда разрезание ДНК происходит строго по оси симметрии узнаваемой последовательности (пример эндонуклеазы рестрикции с такой специфичностью — EcoRV).

Метилтрансферазная
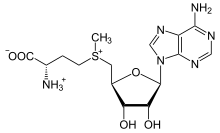
Метилтрансферазы систем рестрикции-модификации добавляют метильные группы к азотистым основаниям нуклеотидных остатков ДНК. Метилирование может проходить по N5 и N6 позициям в аденине, N4 и С5 — в цитозине. Единственный донор метильных групп для ДНК-метилтрансфераз — S-аденозин-L-метионин. В большинстве случаев, метилируется только вторая цепь полуметилированной ДНК, а полностью неметилированная ДНК расщепляется за счёт эндонуклеазной активности СР-М.
Все СР-М требуют наличия Mg2+ в качестве кофактора. СР-М первого и третьего типа нуждаются в АТФ, а четвёртого — в ГТФ. S-аденозилметионин может служить не только донором метильных групп, но и аллостерическим регулятором.
Классификация
В настоящее время на основании субъединичной структуры, субстратной специфичности, потребности фермента в кофакторах и характере расщепления ДНК[1] выделяют четыре типа систем рестрикции-модификации.[5][6]
Тип I
СРМ первого типа образованы пятью субъединицами, которые функционируют как единое целое. Субъединицы обозначаются аббревиатурой Hsd (host specificity determinant) и буквой, соответствующей функции (M — ДНК-метилтрансфераза, R — эндонуклеаза рестрикции, S — распознавание субстрата). СР-М первого типа представляют собой комплекс двух HsdM, двух HsdR и одной HsdS. HsdR расщепляет фосфодиэфирные связи в ДНК и обладает геликазной активностью. HsdM производит метилирование остатков аденина в составе сайтов рестрикции по шестому атому азота (m6A). HsdS обеспечивает распознавание определённых участков ДНК, определяя специфичность СР-М.[7]
При действии на неметилированную ДНК преобладает нуклеазная активность, метилирование de novo может осуществляться с крайне низкой эффективностью, что позволяет бактериофагам преодолеть действие СР-М и приобрести возможность размножаться в новом штамме (подробнее об этом см. выше).
Сайт рестрикции представляет собой асимметричную последовательность из двух частей: 5' последовательность из 3-5 специфичных нуклеотидов отделена 6-8 нуклеотидами любого типа от 3' специфичной последовательности из 4-5 пар оснований. После узнавания мишени ферментативный комплекс перемещается по молекуле ДНК, расплетая её (геликазная активность), до момента встречи с каким-либо препятствием (например, другим белком). Таким образом, разрыв вносится на большом произвольном расстоянии (тысячи пар оснований) от сайта рестрикции.[7] Для расщепления ДНК СР-М типа I необходим гидролиз АТФ. Это связано с тем, что для перемещения по молекуле ДНК и её расплетания после распознавания сайта СР-М требуется энергия. АТФ утилизируется при помощи т. н. DEAD-мотора[7] — консервативной структуры из двух доменов, характерной для хеликаз и некоторых других белков (например, молекулярного мотора Sec-транслоказы SecA).[8]
Данный тип разделяют на четыре семейства (IA-D) на основании генетической комплементации, гибридизации ДНК, и иммунной кросс-реактивности (перекрестной реакции с антителами).[9]
Тип II
В системах рестрикции-модификации этого типа метилтрансферазная и нуклеазная активности в большинстве случаев обеспечиваются независимыми белками. Эндонуклеазы разрезают ДНК в строго определённых позициях внутри или около сайта рестрикции, в результате концы ДНК в месте разрыва имеют 3'-гидроксильные группы и 5'-фосфатные. Ввиду данных особенностей, эндонуклеазы этого типа (особенно IIP) широко используются в генетической инженерии. Для функционирования СР-М II не требуется АТФ или другие источники энергии. Активные нуклеазы могут существовать в виде мономера, гомодимера или гомотетрамера (для разных систем).[5]
Метилтрансферазы обычно функционируют в форме мономера. Метилирование происходит по четвёртому (N) или пятому (C) положению в остатке цитозина, либо по шестому (N) — аденина (для разных систем, каждый отдельный фермент обладает строгой специфичностью).[5]
Выделяют несколько подгрупп СР-М типа II, некоторые системы могут принадлежать сразу к нескольким из них.[5]
- Тип IIP. Данная группа объединяет СР-М, которые распознают палиндромы (отсюда литера P).[5] Палиндром представляет собой симметричную последовательность, то есть одинаковую при чтении по обоим цепям ДНК в одном направлении (5'-3' или 3'-5'), например:

Длина распознаваемого палиндрома в большинстве случаев составляет 4, 6 или 8 нуклеотидов. Расщепление происходит в фиксированном положении внутри сайта рестрикции или непосредственно вблизи него. При этом различные ферменты вызывают образование как липких, так и тупых концов.
- Тип IIA. Данная группа объединяет СР-М, которые распознают асимметричные последовательности ДНК. Различные нуклеазы СР-М данной группы могут вносить разрез в ДНК как внутри сайта рестрикции, так и вне его. Обычно имеется один ген нуклеазы и два — метилтрансферазы, по одному для модификации каждой из цепей ДНК в асимметричном сайте.
- Тип IIB. Эндонуклеазы систем данного типа вносят разрывы в обе цепи ДНК по обе стороны от сайта рестрикции.
- Тип IIC. СР-М, в которых функции нуклеазы и метилтрансферазы сочетаются в одной полипептидной цепи. К данной группе относятся все представители типов IIB, IIG, и некоторые — IIH.
- Тип IIE. Взаимодействуют с двумя копиями распознаваемой последовательности, в одну из них вносится разрыв, а вторая играет роль аллостерического регулятора.
- Тип IIF. Взаимодействуют и разрезают одновременно две копии распознаваемой последовательности.
- Тип IIG. Нуклеаза и метилтрансфераза объединены в составе одного белка (то есть входят в тип IIC). В отличие от остальных СР-М второго типа, могут стимулироваться или ингибироваться S-аденозилметионином. Распознают как симметричные, так и асимметричные сайты. Включает некоторых представителей типов IIP и IIA.
- Тип IIH. Гены белков СР-М данного типа организованы сходно с системами типа I (имеется три гена и три различных белка), но биохимические характеристики соответствуют типу II.
- Тип IIM. В отличие от других, распознают метилированные сайты. Разрезание ДНК происходит в строго определённой позиции.
- Тип IIS. К данной группе относится часть СР-М типа IIA, которые вносят разрыв хотя бы в одну из цепей ДНК за пределами сайта рестрикции.
- Тип IIT. Ферменты образованы двумя различными субъединицами.
Тип III
СР-М типа III включают две субъединицы (Res и Mod), которые объединяются в гетеротетрамер (Res2Mod2)[7] с эндонуклеазной и метилтрансферазной активностями. Res-субъединица обладает хеликазной активностью и требует для функционирования гидролиза АТФ.[6] В отличие от СР-М первого типа, для гидролиза ДНК требуется взаимодействие двух комплексов ферментов. Они распознают два идентичных сайта рестрикции, расположенных в противоположной ориентации. Сайты могут быть не метилированы или метилированы по одной цепи.[7]
Mod-субъединица может функционировать отдельно от Res, выполняя функцию метилтрансферазы (m6A). В то же время нуклеазная активность Res-субъединицы проявляется, только когда она находится в комплексе с Mod.[5]
Тип IV
СР-М типа IV расщепляют только модифицированную ДНК, имеющую в составе метилированные, гидроксиметилированные или гликозил-гидроксиметилированые основания. Для расщепления ДНК требуется гидролиз ГТФ. Эндонуклеазная активность обеспечивается одним полипептидом. Метилтрансферазная активность отсутствует [10]. Нуклеазная активность аллостерически активируется S-аденозилметионином. Сайт рестрикции асимметричный, состоит из двух разнесенных частей. Разрезание ДНК происходит около одного из сайтов.[6][7]
Литература
- ↑ 1 2 3 Щелкунов С. Н. Генетическая инженерия: Учеб.-справ. пособие. — 2-е изд., испр. и доп. — Новосибирск: Сиб. унив. изд-во, 2004. — 496 с ISBN 5-94087-098-8
- ↑ Luria S.E., Human M.L. A nonhereditary, host-induced variation of bacterial viruses (англ.) // Journal of Bacteriology[англ.] : journal. — 1952. — October (vol. 64(4)). — P. 557—569. — PMID 12999684.
- ↑ Arber W., Dussoix D. Host specificity of DNA produced by Escherichia coli. I. Host controlled modification of bacteriophage lambda. (англ.) // J Mol Biol[англ.] : journal. — 1962. — July (vol. 5). — P. 18—36. — PMID 13862047.
- ↑ Smith H. O., Nathans D. Letter: A suggested nomenclature for bacterial host modification and restriction systems and their enzymes. (англ.) // J Mol Biol.[англ.] : journal. — 1973. — December (vol. 81(3)). — P. 419—423. — PMID 4588280.
- ↑ 1 2 3 4 5 6 7 Roberts R. J., Belfort M., Bestor T., Bhagwat A. S., Bickle T. A., Bitinaite J., Blumenthal R. M., Degtyarev SKh, Dryden D. T., Dybvig K., Firman K., Gromova E. S., Gumport R. I., Halford S. E., Hattman S., Heitman J., Hornby D. P., Janulaitis A., Jeltsch A., Josephsen J., Kiss A., Klaenhammer T. R., Kobayashi I., Kong H., Krüger D. H., Lacks S., Marinus M. G., Miyahara M., Morgan R. D., Murray N. E., Nagaraja V., Piekarowicz A., Pingoud A., Raleigh E., Rao D. N., Reich N., Repin V. E., Selker E. U., Shaw P. C., Stein D. C., Stoddard B. L., Szybalski W., Trautner T. A., Van Etten J. L., Vitor J. M., Wilson G. G., Xu SY. A nomenclature for restriction enzymes, DNA methyltransferases, homing endonucleases and their genes. (англ.) // Nucleic Acids Res. : journal. — 2003. — April (vol. 31(7)). — P. 1805—1812. — PMID 12654995.
- ↑ 1 2 3 Патрушев Л. И. Искусственные генетические системы. — М.: Наука, 2004. ISBN 5-02-032893-6
- ↑ 1 2 3 4 5 6 Dryden D. T., Murray N. E., Rao DN. Nucleoside triphosphate-dependent restriction enzymes. (фр.) // Nucleic Acids Res. : magazine. — 2001 29(18). — Vol. 29(18). — P. 3728—3741. — PMID 11557806.
- ↑ Papanikolau Y., Papadovasilaki M., Ravelli R. B., McCarthy A. A., Cusack S., Economou A., Petratos K. Structure of dimeric SecA, the Escherichia coli preprotein translocase motor. (англ.) // J Mol Biol.[англ.] : journal. — 2007. — Vol. 366(5). — P. 1545—1557. — PMID 17229438.
- ↑ Sistla S., Rao DN. S-Adenosyl-L-methionine-dependent restriction enzymes. (неопр.) // Crit Rev Biochem Mol Biol.. — 2004. — Т. 39(1). — С. 1—19. — PMID 15121719.
- ↑ Tock M. R., Dryden DT. The biology of restriction and anti-restriction (неопр.) // Curr Opin Microbiol.. — 2005. — August (т. 8, № 4). — С. 466—472. — ISSN 1369-5274. — PMID 15979932.
См. также
- Эндонуклеаза рестрикции
- ДНК-метилтрансфераза
- Метилирование ДНК
- CRISPR
Ссылки
- Daniel Nathans. Restriction Endonucleases, Simian Virus 40, and the New Genetics. Nobel Lecture, 1978
- Hamilton O. Smith. Nucleotide Sequence Specificity of Restriction Endonucleases. Nobel Lecture, 1978
- База данных по ферментам рестрикции (англ.)
- Программа по созданию карт рестрикции (англ.)
- Завильгельский Г.Б., Расторгуев С.М. Молекулярная мимикрия против «иммиграционного контроля». Химия и жизнь, 2006, №7, с. 42—45.