Сопряжённое присоединение по Михаэлю
Реакция Михаэля — это нуклеофильное присоединение карбаниона или другого нуклеофильного агента к α,β-ненасыщенному карбонильному соединению.[1] Описываемая реакция относится к большому классу реакций сопряжённого присоединения. Это один из лучших методов для создания С-С связей. В настоящее время существует большое количество модификаций этой реакции, в том числе асимметрических.[2]

Механизм
Механизм реакции, где в качестве нуклеофильного агента выступает 1, выглядит следующим образом:

Депротонирование 1 основанием приводит к образованию 2, который стабилизирован электроно-акцепторными карбонильными группами. Структуры 2А-2С являются резонансными структурами, две из которых представляют собой енолят-ионы. Образовавшийся нуклеофил реагирует с электрофильным алкеном 3 с образованием 4 в реакции сопряжённого присоединения. В заключительной стадии протонируется получившийся енолят-ион с образованием 5.
Направление реакции определяется в большей степени орбитальными, нежели электростатическими, факторами. ВЗМО стабилизированного енолят-иона имеет большой коэффициент на центральном атоме углерода, в то время как НСМО многих α,β-ненасыщенных карбонильных соединений имеет большой коэффициент на β-атоме углерода. Таким образом оба реагента могут рассматриваться как мягкие. Такие граничные орбитали обладают одинаковой энергией и эффективно реагируют, образуя новую С-С связь.
Как и альдольная реакция, реакция Михаэля может протекать через образование енола, эфира силильного енола в реакции Мукаиямы — Михаэля, или чаще — через енолят-ион. В последнем случае стабилизированное карбонильное соединение депротонируется сильным основанием или кислотой Льюиса и слабым основанием. Образовавшийся енолят-ион атакует активированный алкен с 1,4-региоселективностью, образуя углерод-углеродную связь.
В большинстве случаях реакция при низких температурах необратима.
Асимметричная реакция Михаэля
Последние исследования были направлены на расширение сферы применения асимметричной реакции Михаэля. На сегодняшний момент наиболее распространённые методы основаны на применении хиральных межфазных катализаторов, таких как, асимметричные четвертичные соли аммония.
В реакции между циклогексаноном и β-нитростиролом, изображённой ниже, производное пролина, в качестве основания, действует совместно с протонной кислотой, такой как п-толуолсульфоновая кислота:[3]

В реакции значительно преобладает продукт син-присоединения. Предполагается, что подобная селективность в переходном состоянии наблюдается за счёт енамина, образующегося в реакции между пролином и кетоном, и β-нитростирола, которые образуют устойчивый интермедиат, однозначно определяющий направление дальнейших превращений.

Известным примером асимметричной реакции Михаэля является синтез варфарина из 4-гидроксикумарина и 4-фенил-3-бутен-2-она, впервые осуществлённый ещё в 1944 году.[4]

Существует несколько асимметричных версий этой реакции с использованием хиральных катализаторов.
Реакция Мукаиямы — Михаэля
В реакции Мукаиямы[нем.] — Михаэля нуклеофилом является силиловый эфир, а в качестве катализатора обычно выступает тетрахлорид титана:[5]

Историческая справка
Предпосылкой исследования Артура Михаэля 1887 года являлась публикация[6] 1884 года, в которой описывалась реакция этил-2,3-дибромпропионата с диэтилмалонатом натрия с образованием производного циклопропана.
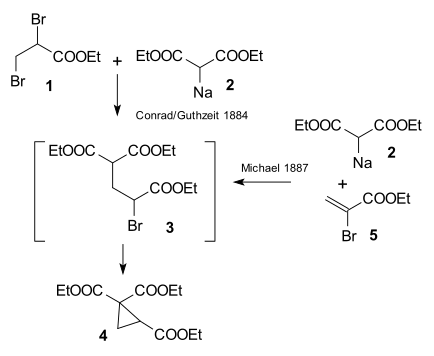
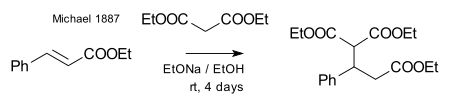
Михалю удалось получить тот же продукт, заменив пропионат на этиловый эфир 2-бромакриловый кислоты. Он предположил, что эта реакция протекает как присоединение к двойной связи акриловой кислоты. Затем он подтвердил это предположение, взаимодействием диэтилмалоната и этилового эфира коричной кислоты:[7]
В том же году Р. Л. Кляйзен утверждал, что открыл данную реакцию раньше. По его словам в 1883 году он и Т. Комненос наблюдали продукты присоединения к двойным связям как побочные продукты реакции конденсации малоновой кислоты с альдегидами.[8] Тем не менее, согласно биографу Такаси Токорояме, это утверждение является необоснованным.
Примечания
- ↑ Little, R. D.; Masjedizadeh, M. R.; Wallquist, O.; McLoughlin, J. I. The Intramolecular Michael Reaction // Org. React.. — 1995. — № 47. — С. 315–552.
- ↑ Hunt, I. Chapter 18: Enols and Enolates – The Michael Addition reaction. — University of Calgary.
- ↑ Pansare, S. V.; Pandya, K. Simple Diamine- and Triamine-Protonic Acid Catalysts for the Enantioselective Michael Addition of Cyclic Ketones to Nitroalkenes // Journal of the American Chemical Society. — 2006. — № 128 (30). — С. 9624–9625.
- ↑ Ikawa, M.; Stahmann, M. A.; Link, K. P. Studies on 4-Hydroxycoumarins. V. The Condensation of α,β-Unsaturated Ketones with 4-Hydroxycoumarin // Journal of the American Chemical Society. — 1944. — № 66 (6). — С. 90.
- ↑ Mukaiyama, T. (1977). «Titanium Tetrachloride in Organic Synthesis [New synthetic methods (21)]». Angew. Chem., Int. Ed. Engl. 16 (12): 817—826. doi:10.1002/anie.197708171
- ↑ Conrad, M.; Guthzeit, M. (1884). «Ueber die Einwirkung von α-β-Dibrompropionsäure auf Malonsäureester». Berichte der Deutschen Chemischen Gesellschaft 17 (1): 1185—1188. doi:10.1002/cber.188401701314
- ↑ Tokoroyama, T. (2010). «Discovery of the Michael Reaction». European Journal of Organic Chemistry 2010 (10): 2009—2016. doi:10.1002/ejoc.200901130.
- ↑ Komnenos, T. (1883). «Ueber die Einwirkung von Fettaldehyden auf Malonsäure und Aethylmalonat». Justus Liebig’s Annalen der Chemie 218 (2): 145—167. doi:10.1002/jlac.18832180204










