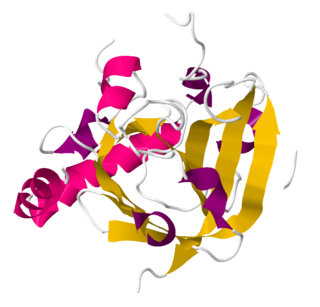Сортаза А
| Sortase A | |
|---|---|
| Идентификаторы | |
| Шифр КФ | 3.4.22.70 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
Сортаза A ( EC 3.4.22.70, SrtA, белок SrtA, сортаза SrtA ) представляет собой фермент . [1] [2] [3] Этот фермент катализирует следующую химическую реакцию
- Фермент катализирует реакцию сортировки клеточной стенки, в которой поверхностный белок с сигналом сортировки, содержащий мотив LPXTG, расщепляется между остатками Thr и Gly.
Этот фермент принадлежит к семейству пептидаз C60.
Структура
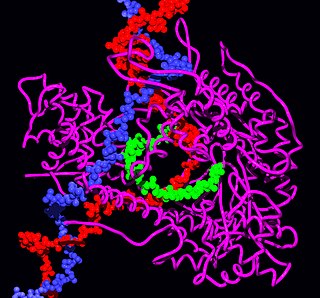
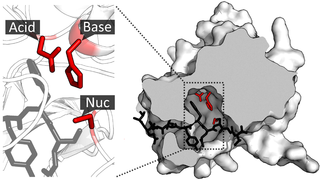
Сортаза A имеет восьмицепочечную β-бочкообразную складку с гидрофобной щелью, образованной β7-β8 цепями. Эта щель окружена петлями β3-β4, β2-β3, β6-β7 и β7-β8. Каталитический остаток цистеина находится в этой щели и принимает последующее связывание нуклеофильного агента. Петля β3-β4 содержит сайт связывания кальция, который связывает кальций посредством координации с остатком в петле β6-β7. Такое связывание замедляет движение петли β6-β7, позволяя субстрату сортазы связываться и увеличивать его активность в восемь раз. [4]
Использование в белковой инженерии
Сортаза A широко используется в качестве инструмента in vitro для посттрансляционной модификации белков на N- и C-концах с помощью присоединенной метки. Эти метки включают биотин, флуорофоры, сшивающие агенты и многофункциональные зонды. [5]
В обоих случаях одна молекула сконструирована так, чтобы содержать мотив LPXTG на одном конце, а другая молекула сконструирована так, чтобы содержать мотив (Gly) n на другом конце. При расщеплении мотива LPXTG, Сортаза образует промежуточный тиоэфир с сконструированной молекулой. Этот промежуточный продукт затем разрешается нуклеофильной атакой со стороны (Gly) n-содержащей молекулы с образованием слияния двух молекул с промежуточным мотивом LPXT (Gly)n.
Чтобы достичь N-концевого мечения белка, сконструирован мотив LPXTG, который находится на С-конце метки. Белок сконструирован с N-концом (Gly)n. Чтобы достичь С-конца одного и того же белка, сконструирован мотив LPXTG, который находится на С-конце белка. Молекула (Gly)n сконструирована так, чтобы она содержала метку на своем С-конце.
Наконец, как N, так и C-концы белков могут быть помечены с помощью сортаз с различной субстратной специфичностью. Например, Сортаза A Streptococcus pyogenes распознает и расщепляет мотив LPXTA и принимает нуклеофилы на основе Ala. Этот SrtA также распознает и расщепляет мотив LPXTG с меньшей эффективностью. Однако Staph. A. Сортаза A не распознает субстраты LPXTA и, следовательно, ортогональны последовательности LPXTA.
Кроме того, Сортаза А также использовалась для кусочного создания белков, белковых доменов и пептидов. [6]
Ссылки
- ↑ "Purification and characterization of sortase, the transpeptidase that cleaves surface proteins of Staphylococcus aureus at the LPXTG motif". Proceedings of the National Academy of Sciences of the United States of America. 96 (22): 12424—9. October 1999. doi:10.1073/pnas.96.22.12424. PMID 10535938.
- ↑ "Crystal structures of Staphylococcus aureus sortase A and its substrate complex". The Journal of Biological Chemistry. 279 (30): 31383—9. July 2004. doi:10.1074/jbc.m401374200. PMID 15117963.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Crystal structure of Streptococcus pyogenes sortase A: implications for sortase mechanism". The Journal of Biological Chemistry. 284 (11): 6924—33. March 2009. doi:10.1074/jbc.m805406200. PMID 19129180.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "The structure of the Staphylococcus aureus sortase-substrate complex reveals how the universally conserved LPXTG sorting signal is recognized". The Journal of Biological Chemistry. 284 (36): 24465—77. September 2009. doi:10.1074/jbc.M109.022624. PMID 19592495.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Site-specific protein labeling via sortase-mediated transpeptidation". Current Protocols in Protein Science. Chapter 15: Unit 15.3. April 2009. doi:10.1002/0471140864.ps1503s56. PMID 19365788.
- ↑ "Making and breaking peptide bonds: protein engineering using sortase". Angewandte Chemie. 50 (22): 5024—32. May 2011. doi:10.1002/anie.201008267.