Спирамицин
| Спирамицин | |
|---|---|
 | |
| Химическое соединение | |
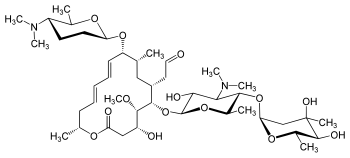
| ИЮПАК | (4R,5S,6R,7R,9R,10R,11E,13E,16R)-10-{[(2R,5S,6R)-5-(диметиламино)-6-метилтетрагидро-2H-пиран-2-ил]окси}-9,16-диметил-5-метокси-2-оксо-7-(2-оксоэтил)оксациклогексадека-11,13-диен-6-ил 3,6-дидеокси-4-O-(2,6-дидеокси-3-C-метил-α-L-рибо-гексопиранозил)-3-(диметилоамино)-α-D-глюкопиранозид |
| Брутто-формула | C43H74N2O14 |
| Молярная масса | 843.053 г/моль |
| CAS | 8025-81-8 |
| PubChem | 5356392 |
| Состав | |
| Классификация | |
| АТХ | J01FA02 |
| Фармакокинетика | |
| Связывание с белками плазмы | 10-25% |
| Метаболизм | преимущественно, в печени |
| Период полувывед. | 8 часов |
| Экскреция | с жёлчью (концентрация выше сывороточной в 15-40 раз), почечная - 10% дозы |
| Лекарственные формы | |
| Таблетки 1,5 и 3 МЕ, раствор для в/в инфузий 1,5 МЕ | |
| Способы введения | |
| Перорально, внутривенно капельно | |
| Другие названия | |
| Ровамицин, Спирамицин-Веро, Дорамицин-Реб | |
Спирамицин (Spiramycin, в химии известен также как Формацидин, Formacidine) — природный антибиотик, получаемый из актиномицета Streptomyces ambofaciens, первый представитель 16-членных макролидов. Структурную основу спирамицина составляет лактонное кольцо, состоящее из 16 атомов углерода, к которому присоединены три углеводных остатка: форозамин, микаминоза и микароза. Препарат представляет собой естественным образом полученное сочетание трёх химических форм (спирамицин I, II, III). Распространён в странах Европы, Латинской Америке, Канаде. В США не прошёл регистрацию FDA, но может применяться c ведома этических комитетов учреждений для лечения токсоплазмоза у беременных.
Торговые названия
| Торговое название | Производитель | Страна |
|---|---|---|
| Дорамицин | World Medicine | Турция |
| Ровамицин | Sanofi | Франция |
Формы выпуска
В Российской Федерации — таблетки 1,5 (500 мг) и 3 млн МЕ (1000 мг), раствор для приготовления инъекций 1,5 млн МЕ (500 мг). За рубежом выпускается также в виде ректальных свечей, суспензии для приёма внутрь.
История
Спирамицин выделен в 1951 и формально описан в 1954 году S. Pinnert-Sindico в 1954, как активное в отношении грамположительных микроорганизмов вещество. Производящий его микроорганизм — Streptomyces ambofaciens выделен из почвы на юге Франции.[1][2] Выпуск пероральной формы препарата под названием «Ровамицин» был начат во Франции фирмой Rhône-Poulenc Rorer с 1955 года. В 1958 выявлена его активность в отношении Toxoplasma gondii.[3] С 1968 применяется в лечении токсоплазмоза у беременных[4]. В 1987 году начато производство формы спирамицина для парентерального введения.
Фармакокинетика
Абсорбция
Всасывание при пероральном применении неполное, биодоступность составляет в среднем 33 % — 39 % (в пределах 10 — 69 %). Всасывание дольше, чем у эритромицина, что возможно связано с ионизацией препарата в кислой среде желудка. Приём с пищей снижает биодоступность препарата на 50 % и замедляет набор его концентрации в сыворотке.[5]
Распространение
Спирамицин достигает высоких концентраций в тканях легких, бронхов, миндалин, придаточных пазух носа и тазовых органов женщин, причём высокие концентрации в них сохраняются после снижения сывороточных концентраций. Концентрация в слюне в 1,3 — 4,8 раз выше, чем в сыворотке.[6] Препарат проникает через плацентарный барьер, а также в молоко. Тем не менее, концентрация в крови плода составляет 50 % от концентрации в крови матери. Повышенная концентрация обнаружена также в желчи, полиморфноядерных нейтрофилах и макрофагах. [7] Препарат не проникает через гематоэнцефалический барьер. Объём распространения составляет 383—660 литров.
Выведение
В отличие от других макролидов, метаболизм практически не связан с системой цитохрома P450. С жёлчью выводится до 80 % дозы, с почками 4-14 % дозы.
Прочие свойства
Связь с протеинами: самая низкая среди макролидов — 10 — 25 %.[8]
Биотрансформация: метаболиты спирамицина до конца не изучены, метаболизм происходит в печени
Период полураспада:
- при внутривенном введении: у молодых (18 — 32 лет) 4,5 — 6,2 часов. У пожилых (73 — 85 лет) около 9,8 — 13,5 часов.
- при пероральном введении: 5,5 — 8 часов
- при ректальном введении (у детей, в России не предусмотрено): около 8 часов
Время достижения максимума концентрации:
- при внутривенном введении: при завершении введения
- при пероральном введении: 3 — 4 часа
- при ректальном введении: (у детей) 1,5 — 3 часа
Максимальная сывороточная концентрация
- при внутривенном введении: 2,3 мг/мл при введении 500 мг
- при пероральном введении: около 1 мг/мл при введении 1 мг,1,6 — 3,1 мг/мл при введении 2 мг
- при ректальном введении (у детей): около 1,6 мг/мл при дозе 1,3 млн единиц
Фармакодинамика
Механизм действия
- Природный антибиотик из группы макролидов, действует бактериостатически (при использовании в высоких дозах может действовать бактерицидно в отношении более чувствительных штаммов): подавляет синтез белка в микробной клетке за счет обратимого связывания с 50S-субъединицей рибосом, что приводит к блокаде реакций транспептидации и транслокации. В отличие от 14-членных макролидов способен соединяться не с одним, а с тремя (I—III) доменами субъединицы, что, возможно, обеспечивает более стойкое связывание с рибосомой и, следовательно, более длительный антибактериальный эффект.
- Спирамицин обладает иммуномодулирующими свойствами, характеризующимися усилением хемотаксиса, адгезии и фагоцитарной активности нейтрофилов, уменьшением трансформации лимфоцитов, увеличением продукции интерлейкина-6.
- Постантибиотический эффект. Для спирамицина характерен длительный постантибиотический эффект, выраженный в большей степени, чем у 14-членных макролидов. Постантибиотический эффект характеризуется продолжением подавления роста бактерий при удалении антибиотика из среды и имеет важное значение в антимикробном действии антибиотиков. Продолжительность постантибиотического эффекта спирамицина в отношении стрептококков и пневмококков составляет от 4 до 9 часов, в отношении золотистого стафилококка — около 9 часов.
- Проантибиотический эффект. Отмечено, что в субингибирующих концентрациях (то есть в концентрациях ниже МПК в 2 и более раз) спирамицин не обладает бактерицидным или бактериостатическим действием, но способен изменять морфологию и снижать функциональную активность бактериальной клетки, в результате чего уменьшается вирулентность микроорганизмов и увеличивается фагоцитарная и бактерицидная способность нейтрофилов и макрофагов.
Показано, что антибактериальная активность спирамицина увеличивается в 2—4 раза в присутствии сыворотки крови.
Спектр антимикробной активности
| Группа | Вид | Активность |
|---|---|---|
| Грамположительные бактерии | Streptococcus pyogenes (гемолитический стрептококк группы A).[9] | Чувствителен |
| Streptococcus viridans[2] | Чувствителен | |
| Corynebacterium diphtheriae[2][9] | Чувствителен | |
| Staphylococcus aureus, чувствительный к метициллину.[9] | Чувствителен | |
| Streptococcus pneumoniae[9] | Чувствителен | |
| Enterococcus.[9] | Низкая чувствительность | |
| Грамотрицательные бактерии | Neisseria meningitidis[2][9] | Чувствителен |
| Bordetella pertussis[2][9] | Чувствителен | |
| Campylobacter.[2][9][10] | Чувствителен | |
| Clostridium[2][9] | Чувствителен | |
| Haemophilus influenzae[9] | Умеренно чувствителен | |
| Neisseria gonorrhoeae[2] | Низкая чувствительность | |
| Enterobacter[9] | Резистентен | |
| Pseudomonas[9] | Резистентен | |
| Bacteroides fragilis[9] | Резистентен | |
| Прочие организмы | Mycoplasma pneumoniae.[9][10] | Чувствителен |
| Chlamydia trachomatis.[9][10] | Чувствителен | |
| Toxoplasma gondii.[9][10] | Чувствителен | |
| Legionella pneumophila.[10] | Чувствителен | |
| Spirochaetes.[10] | Чувствителен |
Существует перекрёстная устойчивость между спирамицином и эритромицином. В настоящее время назначают обычно для лечения токсоплазмоза беременных и врожденного токсоплазмоза (в качестве альтернативы — комбинация пириметамина с сульфадиазином более эффективна, однако спирамицин более безопасен — не выявлено тератогенного действия). Спирамицин снижает риск передачи токсоплазмоза от беременной женщины плоду; не влияет на тяжесть болезни у уже инфицированного плода.
Парадокс спирамицина
Не подвергаясь клеточному метаболизму, спирамицин находится в клетках в активном состоянии. В результате этого наблюдается высокая клиническая эффективность спирамицина даже в случае инфекций, вызванных слабочувствительными к нему in vitro микроорганизмами. Это явление получило название «парадокс спирамицина»[11]
Лекарственные взаимодействия
В отличие от эритромицина, спирамицин не метаболизируется в печени через систему цитохрома P450, благодаря чему отсутствует его взаимодействие с циклоспорином и теофиллином.[12][13] Сочетание препаратов карбидопа и леводопа при совместном приёме со спирамицином привело к удлинению среднего времени выведения леводопы, которое, как полагают, связано с ингибированием поглощения карбидопы вследствие изменения моторики кишечника.[14] На фоне приёма спирамицина возможно увеличение значений АлАТ и щелочной фосфатазы.[15]
Показания
- Токсоплазмоз во время беременности (в качестве альтернативного средства).
- Бактериальные инфекции (препарат II ряда), вызванные чувствительными микроорганизмами: острая внебольничная пневмония, (в том числе атипичная, вызванная Mycoplasma, Chlamydia, Legionella), обострение хронического бронхита, острый бронхит; синусит, тонзиллит, отит; остеомиелит, артрит; экстрагенитальный хламидиоз, простатит, уретриты различной этиологии; заболевания, передающиеся половым путём (в том числе генитальный хламидиоз, сифилис, гонорея и их сочетание).
- Инфекции кожи: рожа, инфицированные дерматозы, абсцесс, флегмоны (в том числе в стоматологии).
- Токсоплазмоз; профилактика менингококкового менингита среди лиц, контактировавших с больными не более чем за 10 дней до его госпитализации.
- Профилактика острого суставного ревматизма.
- Лечение бактерионосительства возбудителей коклюша и дифтерии.
Противопоказания
Повышенная чувствительность к спирамицину и другим компонентам препарата, период лактации, дефицит фермента глюкозо-6-фосфатдегидрогеназы (риск возникновения острого гемолиза), детский возраст (до 6 лет — для таблеток 1,5 млн. МЕ, до 18 лет — для таблеток 3,0 млн МЕ, для внутривенных инфузий).
C осторожностью: при обструкции жёлчных протоков или печёночной недостаточности.
Побочные действия
Тошнота, рвота, диарея, аллергические реакции (кожная сыпь, зуд), болезненность в месте внутривенного введения; редко — повышение активности АЛТ и ЩФ. В единичных случаях — тромбоцитопения, удлинение интервала Q-T на ЭКГ, холестатический гепатит, острый колит, язвенный эзофагит, повреждение слизистой оболочки кишечника.
Способ применения и дозы
У различных препаратов спирамицина возможны различия в зарегистрированных режимах дозирования, поэтому рекомендуется обязательно сверяться с актуальной инструкцией по медицинскому применению. При нарушении функции почек коррекция дозировки не требуется
Внутрь
Таблетки принимают внутрь, запивая достаточным количеством воды.
Взрослым. Суточная доза обычно составляет 6-9 млн МЕ, разделённая в 2-3 приёма. Максимальная суточная доза составляет 9 млн. МЕ.
Детям. При массе тела 20 кг и выше дозировка составляет 150—300 тыс. МЕ/кг/сут., разделённая на 2-3 приема. Максимальная суточная доза составляет 300 тыс. МЕ/кг/сут.
Профилактика менингококкового менингита: для взрослых — 3 млн. МЕ два раза в сутки в течение 5 дней; для детей 75 тыс. МЕ/кг массы тела два раза в сутки в течение 5 дней.
За рубежом, что не отражено в инструкции по медицинскому применению в Российской Федерации, при тяжёлых инфекциях допускается увеличение суточной дозировки спирамицина до 12-15 млн МЕ.
Внутривенно
Только взрослым. 1,5 млн МЕ в/в каждые 8 часов (4,5 млн МЕ в сутки) путём медленной инфузии. В случае тяжёлых инфекций доза препарата может быть удвоена. Содержимое флакона растворяют в 4 мл воды для инъекций, добавляют к 100 мл 5 % раствора декстрозы. Как только позволит состояние пациента лечение следует продолжить пероральным путём.
Особые указания
Даже при наличии выраженных нарушений функции почек нет необходимости в коррекции режима дозирования. При назначении кормящим женщинам необходимо прекратить кормление, поскольку возможно проникновение в грудное молоко. У спирамицина не выявлено тератогенного действия, поэтому можно без опасения применять у беременных женщин. Уменьшение риска передачи токсоплазмоза плоду во время беременности отмечается с 25 до 8 % при использовании в I триместре, с 54 до 19 % — во II и с 65 до 44 % — в III триместре. У пациентов с заболеваниями печени необходимо периодически контролировать функцию печени в период лечения.
В промышленности
В пищевой промышленности зарегистрирован в качестве пищевой добавки E710.
Примечания
- ↑ Pinnert-Sindico. A new species of streptomyces productive of antibiotics: Streptomyces ambofaciens // Ann. de l'Inst. Pasteur. — 1954. — № 87.
- ↑ 1 2 3 4 5 6 7 8 Pinnert-Sindico, S., L. Ninet, J. Preud'homme and C. Cosar. A new antibiotic--Spiramycin // Ann. de l'Inst. Pasteur. — 1954-1955.
- ↑ Garin JP, Eyles DE. Spiramycin therapy of experimental toxoplasmosis in mice (francés). — Presse Med, 1958. — Май (т. 66, № 42).
- ↑ Garin JP, Pellerat J, Maillard, Woehrle R, Hezez. Theoretical bases of the prevention by spiramycin of congenital toxoplasmosis in pregnant women (francés). — Presse Med, 1968. — Декабрь (т. 76, № 48). Архивировано 21 мая 2016 года.
- ↑ Frydman AM, Le Roux Y, Desnottes JF, et al. Pharmacokinetics of spiramycin in man. — 1988. — Т. 22.
- ↑ Яковлев С.В. Спирамицин: вторая молодость макролидного антибиотика // Трудный пациент. — 2007. Архивировано 16 декабря 2014 года.
- ↑ Gennaro AR, editor. Remington's pharmaceutical sciences. — 1990.
- ↑ Rovamycine (Rhone-Poulenc Rorer). En. Editions du Vidal. — 1994.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Rovamycine (Rhone-Poulenc Rorer). En: Vidal 1994. 70th ed. París: Editions du Vidal, 1994: 1361
- ↑ 1 2 3 4 5 6 Kavi J, Webberley JM, Andrews JM, Wise R. A comparison of the pharmcokinetics and tissue penetration of spiramycin and erythromycin. — 1988. — Т. 22. Архивировано 19 мая 2016 года.
- ↑ Smith C. R. The spiramycin paradox. — 1988. — Т. 22.
- ↑ Kessler M, Netter P, Renoult HE, Trechot P, Dousset B, Bannwarth B. Pharmacokinetic drug interactions of macrolides. — 1990. — Т. 29.
- ↑ Periti P, Mazzei T, Mini E, Novelli A. Lack of effect of spiramycin on cyclosporin pharmacokinetics. — 1992. — Т. 23.
- ↑ Brion N, Kollenbach K, Marion MH, Grégoire A, Advenier C, Pays M. Effect of a macrolide (spiramycin) on the pharmacokinetics of L-dopa and carbidopa in healthy volunteers.
- ↑ Denie C, Henrion J, Schapira M, Schmitz A, Heller FR. Spiramycin-induced cholestatic hepatitis.
Ссылки
- Описание препарата Ровамицин на сайте webapteka
- Инструкция по медицинскому применению препарата Ровамицин на сайте Sanofi (недоступная ссылка)
- Главы из монографии «Спирамицин»
- Описание в «Практическом руководстве по антиинфекционной химиотерапии» Архивная копия от 10 октября 2011 на Wayback Machine
- Особенности взаимодействия Ровамицина с другими лекарственными средствами (недоступная ссылка)
- Научные статьи о препарате в «Antimicrobial Agents And Chemotherapy»



















