Рибонуклеи́новая кислота́ (РНК) — одна из трёх основных макромолекул, которые содержатся в клетках всех живых организмов и играют важную роль в кодировании, прочтении, регуляции и экспрессии генов.

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например, фотосинтетический комплекс и другие комплексы.

Дрозофи́ла фруктовая, дрозофи́ла малая, или дрозофи́ла обыкновенная — двукрылое насекомое, вид плодовой мухи из рода дрозофил, наиболее часто использующийся в генетических экспериментах. В современной биологической литературе часто упоминается как просто «дрозофила» или «плодовая мушка».
Интроны — участки ДНК, копии которых удаляются из первичного транскрипта и отсутствуют в зрелой РНК.
Сплайсинг — процесс вырезания определённых нуклеотидных последовательностей из молекул РНК и соединения последовательностей, сохраняющихся в «зрелой» молекуле, в ходе процессинга РНК. Наиболее часто этот процесс встречается при созревании матричной, или информационной, РНК (мРНК) у эукариот, при этом путём биохимических реакций с участием РНК и белков из мРНК удаляются участки, не кодирующие белок (интроны) и соединяются друг с другом кодирующие аминокислотную последовательность участки — экзоны. Таким образом незрелая пре-мРНК превращается в зрелую мРНК, с которой считываются (транслируются) белки клетки. Большинство генов прокариот, кодирующих белки, не имеют интронов, поэтому у них сплайсинг пре-мРНК встречается редко. У представителей эукариот, бактерий и архей встречается также сплайсинг транспортных РНК (тРНК) и других некодирующих РНК.
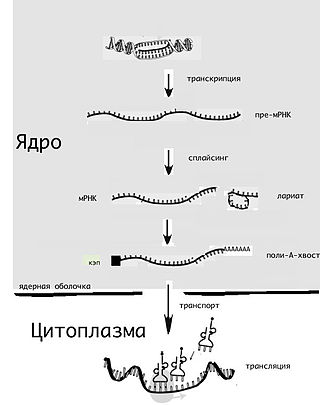
Ма́тричная рибонуклеи́новая кислота́ — РНК, содержащая информацию о первичной структуре белков. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.

Аденозинтрифосфатсинта́за (АТФ-синта́за, АТФ-фосфогидролаза, H+-transporting two-sector ATPase) — группа ферментов, относящихся к классу транслоказ и синтезирующих аденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганического фосфата. Название по номенклатуре — АТФ-фосфогидролаза, однако с августа 2018 года фермент перенесён из третьего (3.6.3.14) в седьмой класс (7.1.2.2), так как катализируемая ферментом реакция протекает по пути, противоположному гидролизу, и не может быть описана с помощью других типов реакций, характеризующие прочие классы ферментов.
Нуклеопротеиды — комплексы нуклеиновых кислот с белками.
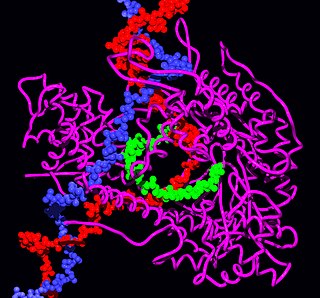
Сплайсосо́ма — ядерная структура, состоящая из молекул РНК и белков и осуществляющая удаление некодирующих последовательностей (интронов) из предшественников мРНК. Этот процесс называется сплайсингом . Сплайсосому составляют пять малых ядерных РНК (мяРНК), и каждая из них связана по меньшей мере с семью белковыми факторами, образуя малые ядерные рибонуклеопротеины (мяРНП). Содержащиеся в сплайсосоме мяРНП называются U1, U2, U4, U5 и U6.

Эндосома — мембранная внутриклеточная органелла, один из типов везикул, образующаяся при слиянии и созревании эндоцитозных пузырьков. Зрелые эндосомы представляют собой образования размером 300-400 нм.
Протонный насос в молекулярной биологии — механизм, создающий или использующий протонный градиент. Протонный насос является белковым комплексом, в котором имеются мембранные белки. В процессе работы протонного насоса осуществляется перенос протонов через мембрану клетки, митохондрии или другого внутриклеточного компартмента. Первичными протонными насосами называют комплексы, в которых разность концентраций используется для синтеза АТФ; вторичные протонные насосы расщепляют АТФ для создания протонного градиента.

Альтернати́вный спла́йсинг — вариант сплайсинга матричных РНК (мРНК), при котором в ходе экспрессии гена на основе одного и того же первичного транскрипта (пре-мРНК) происходит образование нескольких зрелых мРНК. Структурные и функциональные различия образовавшихся транскриптов могут быть вызваны как выборочным включением в зрелую мРНК экзонов первичного транскрипта, так и сохранением в ней частей интронов. Наиболее распространённая разновидность альтернативного сплайсинга предусматривает пропуск экзона: отдельные экзоны транскрипта при определённых условиях могут быть как включены в зрелую мРНК, так и пропущены.

Процессинг РНК — совокупность процессов в клетках эукариот, которые приводят к превращению первичного транскрипта в зрелую РНК.
Молекулярная эволюция — наука, изучающая процесс изменения последовательностей мономеров в биополимерных молекулах в живых организмах, а именно ДНК, РНК и белков. Молекулярная эволюция опирается на принципы эволюционной биологии, молекулярной биологии и популяционной генетики. Задача молекулярной эволюции состоит в объяснении закономерностей таких изменений. Молекулярная эволюция занимается механизмами накопления изменений молекулами, и механизмами закрепления этих изменений в популяциях, а также проблемами видообразования.
Антисмысловая терапия — метод лечения, основанный на выключении/остановке синтеза белка, участвующего в развитии заболевания, путём ингибирования трансляции его матричной РНК с помощью комплементарных к ней коротких нуклеотидных последовательностей.

UniProt — открытая база данных последовательностей белков. Консорциум UniProt действует с 2003 года. Единая база данных UniProt была создана путём объединения нескольких баз. UniProt состоит из четырёх крупных баз данных и охватывает различные аспекты анализа белковых последовательностей. Многие из последовательностей стали известны в результате реализации проектов секвенирования геномов последних лет. Кроме того, база данных UniProt содержит большое количество информации о биологических функциях белков, полученной из научной литературы.
Протеоформы — белковые группы или белковые виды, возникающие за счет модификаций белка: аминокислотных замен (SAP), альтернативного сплайсинга (AS) и посттрансляционных модификаций (PTM), например фосфорилирования. Термин “белковый вид” или “протеоформа” относится к самой малой единице протеома, то есть полипептиду, имеющему уникальную последовательность и несущему уникальный набор посттрансляционных модификаций. Данный термин не стоит путать с изоформой, более частным термином, характеризующим только аминокислотную последовательность.

Я́дерные спе́клы, или спе́клы, или B-снурпосо́мы, или компа́ртменты фа́кторов спла́йсинга, или доме́ны SC-35, или кла́стеры интерхромати́новых гра́нул — ядерные тельца, регулирующие сплайсинг. В ядерных спеклах находятся факторы сплайсинга и малые ядерные рибонуклеопротеины. Изменения в белковом составе и функционировании ядерных спекл приводят к изменениям в альтернативном сплайсинге пре-мРНК, поэтому считается, что ключевой функцией ядерных спекл является регуляция доступности факторов сплайсинга в сайтах транскрипции. Недавние исследования показали, что в ядерных спеклах также находятся белки, задействованные в регуляции локализации хромосом, модификации хроматина, транскрипции, процессинге 3'-концов транскриптов, модификации мРНК, белки, полностью покрывающие мРНК, и мРНК-рибонуклеопротеины, поэтому ядерные спеклы рассматриваются как крупнейшие центры регуляции всех этапов экспрессии ядерных генов.

Finnlakeviridae (лат.) — семейство ДНК-содержащих бактериофагов неясного систематического положения. По состоянию на 2022 год в семейство входит единственный род Finnlakevirus, представленный единственным видом Flavobacterium phage FLiP. Этот вирус был описан в 2010 году и стал первым известным вирусом с геномом в виде одноцепочечной ДНК (оцДНК), который имеет внутреннюю мембрану. Длина генома Finnlakevirus составляет около 9,2 тысяч нуклеотидов. По геномной последовательности Finnlakevirus не демонстрирует сходства с какими-либо другими описанными вирусами.










