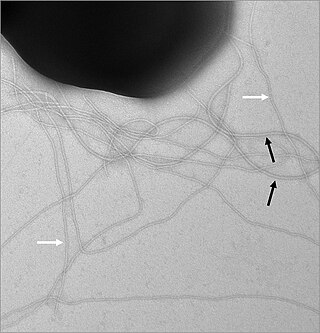
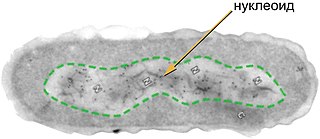
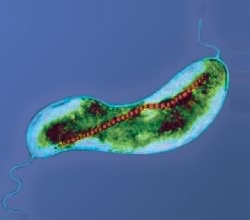
Строение бактериальной клетки

Бактериа́льная кле́тка обычно устроена наиболее просто по сравнению с клетками других живых организмов. Бактериальные клетки часто окружает капсула, которая служит защитой от внешней среды. Для многих свободноживущих бактерий характерно наличие жгутиков для передвижения, а также ворсинок.
Для выведения веществ, в том числе факторов патогенности, в окружающую среду используются системы секреции. Клеточная стенка бактерий обычно содержит пептидогликан. По химическому составу клеточные мембраны бактерий гораздо разнообразнее мембран эукариотических клеток. В отличие от эукариот, бактерии не имеют ограниченного оболочкой ядра и, в большинстве случаев, каких-либо мембранных органелл. Вместе с тем у ряда бактерий имеются клеточные структуры, не имеющие аналогов в двух других доменах.
Геном бактерий состоит из суперскрученных кольцевых хромосом, связанных с гистонподобными белками, и меньших по размерам молекул ДНК — плазмид. Элементы цитоскелета играют важные роли в делении клеток, защите, поддержании формы и определении полярности у различных прокариот. Бактериальные рибосомы меньше рибосом эукариотического типа, но имеют сходный план строения.
Размеры
Как правило, размеры клеток бактерий находятся в пределах от 0,2 до 10 мкм. Существуют, однако, бактерии, видимые невооружённым глазом: клетки бактерии Epulopiscium fishelsoni, обитающей в кишечнике рыбы-хирурга, достигают до 600 мкм в длину и 100 мкм в диаметре, а клетки Thiomargarita namibiensis, населяющей прибрежные воды Намибии, достигает 400—750 мкм в диаметре[1].
Бактерий, клетки которых составляют менее 0,5 мкм в диаметре, называют нанобактериями, или ультрамикробактериями[англ.], они даже способны проходить через мембранные фильтры[англ.]. Среди ультрамикробактерий есть и свободноживущие виды, например, морская бактерия Sphingopyxis alaskensis, и непатогенные эндосимбионты, например, представители рода Holospora, размножающиеся в микро- или макронуклеусе инфузории-туфельки Paramecium caudatum. Многие ультрамикробактерии ведут паразитический образ жизни, в их числе микоплазмы, хламидии и риккетсии. Ультрамикробактерия Bdellovibrio bacteriovorus размножается в периплазматическом пространстве клеток других бактерий и питается продуктами лизиса хозяйской клетки, за что её часто относят к хищным бактериям[2].
Морфология

Форма бактериальной клетки является диагностическим признаком и применяется в их классификации. Чаще всего бактериальные клетки имеют сферическую (кокки) или палочковидную (бациллы) формы, некоторые имеют форму, промежуточную между сферической и палочковидной, и называются коккобациллами. Многие бактерии имеют нитевидную или извитую форму — в виде запятой (вибрионы), спирали (спириллы[англ.]) или вытянутую, закрученную наподобие спирали ДНК (спирохеты)[3].
Часто бактериальные клетки образуют устойчивые сочетания, такие как пары палочек (диплобациллы) или кокков (диплококки), цепочки палочек (стрептобациллы) или кокков (стрептококки), тетрады, пакеты из 4, 8 и более кокков (сарцины), гроздья (стафилококки). Некоторые бактерии образуют розетки, плоские таблички, сети, а также прямые или ветвящиеся трихомы — цепочки плотно примыкающих друг к другу клеток.
Известны бактерии с клетками весьма необычной формы (например, звёздчатые), некоторые бактерии (Corynebacterium, Mycobacterium, Nocardia[англ.]) меняют морфологию в течение жизненного цикла. Актинобактерии формируют мицелий, представители рода Hyphomicrobium образуют гифы с почками[4]. Клетки некоторых бактерий (например, Caulobacter) несут стебельки и прочие придатки[5].

Деление бактериальных клеток
В отличие от многоклеточных организмов, у одноклеточных организмов (и бактерий в том числе) рост, то есть увеличение клетки в размерах, и размножение путём деления клеток тесно связаны[6]. Обычно бактериальные клетки делятся на две равноценные дочерние клетки. Сначала клетка удлиняется, в ней образуется поперечная перегородка. На завершающем этапе дочерние клетки расходятся. Отличительной чертой деления бактериальных клеток является непосредственное участие реплицированной ДНК в процессе деления[7]. В связи с тем, что в подавляющем большинстве случаев прокариотические клетки имеют клеточную стенку, бинарное деление сопровождается формированием септы — перегородки между дочерними клетками, которая затем расслаивается посередине. Процесс деления прокариотической клетки подробно изучен на примере E. coli[8].
В то же время есть примеры неравноценного деления. Например, у грамотрицательной бактерии Caulobacter crescentus[англ.] одна из дочерних клеток подвижная, у неё есть один жгутик для хемотаксиса. Вторая клетка остаётся прикреплённой к субстрату «стебельком». Подвижные клетки дифференцируются в клетки со стеблем после короткого периода свободного плавания. Репликация хромосом и деление клеток происходят только на стадии прикреплённой клетки[9].
В оптимальных условиях бактерии растут и делятся очень быстро, описан пример морской псевдомонады, популяция которой может удваиваться каждые 9,8 минуты[10].
Клеточная мембрана

Как любая живая клетка, бактериальная клетка окружена мембраной, которая представляет собой липидный бислой (её ещё называют цитоплазматической мембраной). Клеточная мембрана поддерживает осмотический баланс клетки, осуществляет разные виды транспорта, в том числе секрецию белков, задействована в образовании клеточной стенки и биосинтезе внеклеточных полимеров, а также получает регуляторные сигналы из внешней среды. Во многих случаях клеточная мембрана может участвовать в синтезе АТФ за счёт трансмембранного электрохимического градиента (протондвижущей силы). Мембрана бактериальной клетки участвует в репликации и разделении дочерних бактериальных хромосом при делении клетки, а также в передаче ДНК посредством трансдукции или конъюгации[11].
Помимо липидов, в состав бактериальных мембран входят различные белки. По химическому составу клеточные мембраны бактерий гораздо разнообразнее мембран эукариотических клеток. Мембранные липиды архей представлены ацил[англ.]- и алкилсодержащими глицеролипидами (в том числе фосфолипидами), а также полиизопреноидами. В отличие от эукариот, меняющих свойства липидного остова мембраны за счёт изменения соотношения между фосфолипидами и холестерином, бактерии изменяют свойства мембраны, варьируя жирные кислоты, входящие в состав липидов. Стероиды обнаруживаются в бактериальных мембранах чрезвычайно редко, и вместо стероидов мембраны содержат гопаноиды, представляющие собой пентациклические[англ.] углеводороды. Гопаноиды активно участвуют в регуляции физических свойств мембран бактериальных клеток[12].
Клеточная стенка

В зависимости от типа строения клеточной стенки бактерии подразделяют на грамположительные и грамотрицательные (названия группам были даны вследствие их разного окрашивания по методу Грама). Большинство бактериальных клеток окружены жёсткой клеточной стенкой, состоящей из полимера пептидогликана, также известного как муреин. Пептидогликан состоит из полисахаридных цепей, скреплённых короткими пептидными сшивками. В большинстве случаев клеточная стенка жизненно необходима для бактерии, поэтому антибиотики, блокирующие её образование (формирование) (например, пенициллин), эффективны против самых разных бактерий. В старых культурах и при несбалансированном росте грамотрицательных бактерий появляются так называемые сферопласты — клетки, лишённые клеточной стенки или имеющие дефекты в ней. Однако, в отличие от протопластов, они взаимодействуют с бактериофагами, размножаются и при благоприятных условиях возвращаются в нормальное состояние. Сферопласты патогенных бактерий называются L-формами, которые получаются в лабораториях в отсутствие клеточной стенки только в изотонических растворах[13][14][15]. Некоторые бактерии, паразитирующие внутри эукариотических клеток, например, микоплазма, не имеют клеточной стенки[16].
Клеточная стенка механически стабилизирована и противостоит внутреннему давлению (тургорному давлению) бактериальной клетки, которое составляет от 2 до 25 атм[17]. Кроме того, она играет ключевую роль в поддержании формы бактериальной клетки[18]. Через слой пептидогликана, имеющий небольшие отверстия, могут проходить только относительно небольшие молекулы (массой до 50—60 кДа), причём размер проникающих молекул не зависит от толщины слоя пептидогликана. В связи с этим в тех случаях, когда через слой пептидогликана должны пройти большие молекулы, такие как белки жгутиков, пилей и ДНК при конъюгации, специфические гидролазы пептидогликана локально расширяют отверстия для их прохода[17].
| Характеристика клеточных стенок грамположительных, грамотрицательных и кислотоустойчивых бактерий[19] | |||
|---|---|---|---|
| Свойство | Грам-положительные бактерии | Грам-отрицательные бактерии | Кислотоустойчивые[англ.] бактерии |
| Пептидогликан | Толстый слой | Тонкий слой | Относительно небольшое количество |
| Тейхоевая кислота | Часто присутствует | Отсутствует | |
| Липиды | Очень мало присутствует | Липополисахарид | Миколовая кислота, другие воски и гликолипиды |
| Внешняя мембрана | Отсутствует | Присутствует | Отсутствует |
| Периплазматическое пространство | Отсутствует | Присутствует | Отсутствует |
| Форма клетки | Всегда жесткая | Жесткая или гибкая | |
| Результаты ферментативного расщепления | Протопласт | Сферопласт | Трудно расщепить |
| Восприимчивость к красителям и антибиотикам | Самая восприимчивая | Умеренно восприимчивая | Наименее восприимчивая |
| Примеры | Staphylococcus aureus | Escherichia coli | Mycobacterium tuberculosis |
Химическое строение

Гликановые цепи пептидогликана обычно состоят из повторяющегося дисахарида N-Ацетилглюкозамин-N-Ацетилмурамовой кислоты (NAG-NAM). В среднем нить образована 30 дисахаридами, но их количество может варьировать. К NAM присоединяется короткий пептид, состоящий из аминокислот D-глутаминовой кислоты, D-аланина и диаминопимелиновой кислоты (DAP) и синтезируемый вне рибосом. Аминогруппы DAP участвуют в образовании сшивок между полисахаридными цепями пептидогликана. При образовании сшивок последний D-аланин пептида высвобождается. У некоторых бактерий в пептидных мостиках присутствуют другие аминокислоты, а у грамположительных бактерий гликановые нити могут также соединяться с одним или несколькими остатками глицина в пептидных мостиках[20].
Грамположительные бактерии

У грамположительных бактерий поверх мембраны есть (от 20 до 50 нм) оболочка из пептидогликана толщиной до 40 молекулярных слоёв[21]. Их положительная окраска по методу Грама связана с тем, что их толстая пептидогликановая клеточная стенка прочно связывает комплекс красителя генцианвиолета[англ.] с йодом, который не вымывается. Поэтому на препаратах грамположительные бактерии выглядят фиолетовыми (у грамотрицательных бактерий этот комплекс вымывается, и они приобретают цвет второго красителя, например сафранина)[22].
Кроме пептидогликана, в клеточной стенке грамположительных бактерий имеются тейхоевые кислоты, которые закрепляются на поверхности клетки, образуя связи с пептидогликаном. Липотейхоевые кислоты взаимодействуют с остатками жирных кислот клеточной мембраны. Тейхоевые и липотейхоевые кислоты представляют собой полианионы, состоящие из повторяющихся звеньев в виде фосфорилированных сахаров или остатков глицерина. Фосфатные группы в составе тейхоевых кислот могут быть заменены на глюкоуронат, в результате чего образуются тейхуроновые кислоты. Синтез тейхуроновых кислот запускается при фосфорном голодании. Блокировка синтеза тейхоевых кислот приводит к гибели бактерий, однако конкретные функции этих соединений точно не установлены[23]. Высказываются предположения, что они действуют наподобие пружин, делая возможным растяжение и сжатие клеточной стенки. Кроме того, за счёт своей полианионной природы тейхоевые кислоты прочно связывают ионы магния, поэтому могут выполнять в клетке роль ионообменника[24].
Поскольку у грамположительных бактерий слой пептидогликана не прикрыт сверху мембраной, перед ними стоит проблема удержания поверхностных белков. В ряде случаев поверхностные белки при помощи специальных ферментов пришиваются к фосфолипидам клеточной мембраны с образованием липопротеинов. Кроме того, поверхностные белки могут закрепляться на поверхности клетки за счёт связывания с пептидогликаном, которое обеспечивается ферментом сортазой. Белки, предназначенные к связыванию с пептидогликаном, несут на N- и C-концах характерные последовательности, например, на N-конце находится сигнальный пептид, благодаря которому белок проходит через клеточную мембрану. Вблизи C-конца находится мотив, распознаваемый сортазой; в него вносится разрыв, после чего белок с отрезанным C-концевым фрагментом ковалентно пришивается к пептидогликану амидной связью[25].
У микобактерий, нокардий и коринебактерий 30 % вещества клеточной стенки составляют липиды, причём у некоторых микобактерий в ней также образованы воски. Такую обогащённую липидами клеточную стенку иногда называют микомембраной. Микомембрана защищает бактерий от неблагоприятных условий среды и антимикробных препаратов[26]. У бактерий родов Mycobacterium, Nocardia, Corynebacterium, Rhodococcus[англ.] и Caseobacter в клеточной стенке обнаруживаются миколовые кислоты. Помимо полисахаридов, у ряда патогенных грамположительных бактерий в клеточных стенках присутствуют белки, например, белок А у стафилококков, который служит важным антигеном. Кроме того, с клеточной стенкой временно, перед высвобождением в окружающую среду, связываются энтеротоксины[англ.][27].
Грамотрицательные бактерии

У грамотрицательных бактерий поверх клеточной мембраны тоже залегает слой пептидогликана, однако он значительно (почти в 40 раз[17]) тоньше, чем у грамположительных бактерий, и прикрыт сверху второй мембраной. Клеточная и наружная мембраны отличаются по химическому составу. Пространство между клеточной и наружной мембранами называется периплазматическим пространством (периплазмой)[28].
В периплазматическом пространстве находится много разнообразных белков: разрушающие биологические молекулы ферменты, транспортные белки, белки, участвующие в метаболизме, а также шапероны, которые регулируют пространственную структуру других белков, защищают их от протеолиза и нежелательных взаимодействий с другими белками. Например, в периплазме происходит образование дисульфидных мостиков и цис-транс-изомеризация пролина, которая является частью процесса созревания белка. Некоторые шапероны периплазмы участвуют в сборке ворсинок. Если под действием стрессовых условий в периплазме происходит агрегация[англ.] неуложенных белковых молекул, то активируется система Cpx. Она состоит из белка CpxA, заякоренного в клеточной мембране, и связанного с ним белка CpxP, который обращён в периплазму. CpxP взаимодействует с неуложенными белками и покидает CpxA, который при этом подвергается аутофосфорилированию[англ.] и далее переносит фосфатную группу на цитоплазматический белок CpxR. Фосфорилированный CpxR запускает экспрессию генов стрессового ответа[29]. По мере роста клетки в периплазматическом пространстве накапливаются продукты метаболизма пептидогликана, которые клетка использует повторно[30].

Наружная мембрана состоит из двух асимметричных слоёв: внутренний слой, обращённый к клетке, состоит из фосфолипидов, а внешний — из липополисахаридов. Внутренний слой почти на 90 % состоит из фосфатидилэтаноламина[13]. Липополисахариды содержат О-полисахарид, коровый полисахарид и остаток липида А[англ.]. О-полисахарид, как правило, состоит из повторяющихся остатков галактозы, глюкозы, рамнозы и маннозы. Центральный (коровый) полисахарид состоит из N-ацетилглюкозамина, глюкозамина, фосфата, гептозы и кетодезоксиоктоната. Липополисахариды токсичны для животных и являются важнейшими антигенами, активирующими иммунную систему в ответ на бактериальное заражение[31]. Наружная мембрана связана со слоем пептидогликана при помощи липопротеинов, N-концы которых связаны с жирными кислотами и погружены во внешнюю мембрану, а C-концы связаны с пептидогликаном. Во внешней мембране имеются белки-порины, а также белки, связанные со сборкой поверхностных структур, конъюгацией и секрецией белковых молекул[32].
От наружной мембраны могут образовываться так называемые везикулы наружной мембраны, имеющие диаметр от 20 до 500 нм. В отпочковывании везикул принимает участие цитоскелет. Образование везикул может быть вызвано тем, что при росте клетки наружная мембрана увеличивается быстрее пептидогликанового слоя, а может вызываться особыми внешними условиями, например, у Porphyromonas gingivalis[англ.] образование везикул запускается нехваткой гемина[англ.]. Стенка везикул состоит из наружной мембраны, и при отпочковывании она может захватывать содержимое периплазмы. Так, у Pseudomonas aeruginosa везикулы наружной мембраны содержат периплазматические ферменты, в числе которых гемолизин, пептидогликан-гидролазы, протеазы, проэластазы, щелочная фосфатаза и фосфолипаза C, а также β-лактамаза, которая позволяет бактериям гидролизовать β-лактамные антибиотики и в периплазме, и во внешней среде. Везикулы наружной мембраны могут также служить для доставки ферментов и фрагмента наружной мембраны к клеткам-мишеням или в необходимый участок внешней среды[33].
В клетке грамотрицательной бактерии имеется от 200 до 400 зон слипания между наружной и клеточной мембранами, которые называют контактами Байера. В области контактов Байера в пептидогликановом слое имеется крупное отверстие, благодаря чему наружная и клеточная мембраны могут сблизиться вплотную. Адгезию мембран могут обеспечивать компоненты некоторых экспортных комплексов. Контакты Байера могут служить для выделения наружу различных молекул, например, субъединиц пилей, кроме того, к ним прикрепляются некоторые бактериофаги[34].
Из-за наличия дополнительного барьера проницаемости (наружной мембраны) для достижения необходимого эффекта грамотрицательные бактерии требуют больших концентраций антибиотиков, чем грамположительные бактерии. Наружная мембрана обеспечивает взаимодействия клеток друг с другом, с клетками организма-хозяина (при патогенезе) и с поверхностью субстрата. Она удерживает такие внешние структурные образования, как пили[30].
У цианобактерий поверх слоя пептидогликана располагается внешняя мембрана, однако с пептидогликаном ковалентно связаны полисахариды, из-за которых, судя по всему, цианобактерии окрашиваются по Граму положительно. Кроме того, наружная мембрана цианобактерий содержит каротиноиды[22].
Формирование клеточной стенки
Синтез пептидогликана протекает в несколько этапов. Дисахариды его гликановых цепей синтезируются в цитозоле, начиная с уридин-5-дифосфата[англ.]-NAM (УДФ-NAM). Синтез пептида начинается на NAM. Он формируется последовательно, присоединение каждой аминокислоты катализируется определённым ферментом. Наконец, пентапептид, связанный с УДФ-NAM, присоединяется к особому липиду клеточной мембраны — бактопренолу[англ.]. Далее к УДФ-NAM присоединяется NAG, УДФ высвобождается, и всё звено, включающее NAM, NAG и пептид, переворачивается и становится обращённым во внешнюю среду, а не в цитоплазму. Поперечные сшивки образуются с участием ферментов DD-транспептидаз[англ.] (которые ингибируются пенициллином), которые катализируют реакцию транспептидации, сопровождающуюся высвобождением остатка D-аланина. Образование гликановых цепей катализируют трансгликозилазы, кроме того, имеются бифункциональные ферменты, обладающие и трансгликозилазной, и транспептидазной активностями[20].
Согласно одной из предложенных моделей, при росте клетки в клеточную стенку сначала добавляются новые нити, и лишь потом происходит разрыв старых связей. У большинства бактерий в клеточной стенке находится множество ферментов автолиза, которые разрушают различные химические связи в пептидогликане[35].
Системы секреции
Под системами секреции у бактерий понимают белковые комплексы, расположенные в клеточной мембране бактерий и служащие для выведения во внешнюю среду различных веществ. В частности, их используют патогенные бактерии для выделения факторов вирулентности[англ.] (преимущественно белковой природы). На основании состава, структура и действия системы секреции делят на несколько типов. Существует по меньшей мере шесть типов систем секреции, специфичных для грамотрицательных бактерий, четыре типа систем секреции уникальны для грамположительных бактерий, а два типа систем секреции имеются у обеих групп бактерий. Типы бактериальных систем секреции и их основные свойства приведены в таблице ниже[26].
| Система секреции | Сигнал секреции | Количество этапов секреции | Уложен ли субстрат | Количество мембран | Грам(+) или грам(-) |
|---|---|---|---|---|---|
| Sec | N-концевой | 1 | Нет | 1 | Обе группы |
| Tat | N-концевой | 1 | Да | 1 | Обе группы |
| I тип | C-концевой | 1 | Нет | 2 | Грам(-) |
| II тип | N-концевой | 2 | Да | 1 | Грам(-) |
| III тип | N-концевой | 1—2 | Нет | 2—3 | Грам(-) |
| IV тип | C-концевой | 1 | Нет | 2—3 | Грам(-) |
| V тип | N-концевой | 2 | Нет | 1 | Грам(-) |
| VI тип | Неизвестен | 1 | Неизвестно | 2—3 | Грам(-) |
| SecA2 | N-концевой | 1 | Нет | 1 | Грам(+) |
| Сортазы | N-концевой (Sec) C-концевой (cws) | 2 | Да | 1 | Грам(+) |
| Инжектосомы | N-концевой | 2 | Да | 1 | Грам(+) |
| VII тип | C-концевой | 1 | Да | 1—3 | Грам(+) |
Внеклеточные структуры
Капсула

У многих бактерий поверх клеточной стенки или внешней мембраны залегает капсула, состоящая из экзополисахаридов[англ.]. Структурной основой капсулы служат линейные или разветвлённые полигликаны и олипептиды, состоящие из одинаковых или разных мономеров. У непатогенных бактерий капсулы служат для защиты высыхания, например, именно благодаря капсуле цианобактерии рода Nostoc могут расти в пустыне. У патогенных бактерий капсула резко увеличивает вирулентность, так как иммунная система плохо справляется с бактериями, покрытыми капсулой: они плохо связываются с антителами и не поддаются фагоцитированию[36].
S-слой
Поверхность некоторых бактерий (как грамположительных, так и грамотрицательных) покрыта S-слоем, состоящим из упорядоченно уложенных белковых субъединиц. У бактерий очень редки случаи, когда S-слой является единственной плотной оболочкой, обычно он сосуществует вместе с пептидогликановой клеточной стенкой. S-слой не играет формообразующей роли и часто утрачивается бактериями, растущими в лабораторных условиях. Сборка S-слоя начинается с того, что его белковые субъединицы секретируются в экзоплазматический компартмент, где они спонтанно агрегируют, связываясь друг с другом гидрофобными, водородными и электростатическими связями. S-слой обеспечивает механическую защиту бактериальной клетки, препятствует попаданию в клетку экзогенных молекул, взаимодействует с бактериофагами. У патогенных бактерий S-слой является важным фактором вирулентности[37].
Жгутик

Большинство бактерий подвижны, и их подвижность обеспечивается одним или нескольким жгутиками, которые представляют собой поверхностные белковые структуры. Расположение жгутиков на клетке может быть различным. У монотрихов имеется только один жгутик, у лофотрихов на одном из полюсов клетки находится пучок жгутиков, у амфитрихов на противоположных полюсах клетки находится по одному жгутику, а у перитрихов многочисленные жгутики разбросаны по всей поверхности клетки. Длина жгутика варьирует, но диаметр обычно составляет 20 нм[38].
Основание бактериального жгутика представлено базальным телом, состоящим из двух (у грамположительных) или четырёх (у грамотрицательных бактерий) белковых колец, стержня и моторных белков. От базального тела отходит крючок, переходящий в филамент, который завершается «шапочкой». Филамент представляет собой жёсткий цилиндр, образованный белком флагеллином. В клеточной мембране находятся кольца M и S, которые часто рассматривают как единое целое. MS-кольцо окружено несколькими моторными белками, которые передают вращающий момент на филамент. У грамотрицательных бактерий, помимо колец M и S, есть ещё два кольца: P, залегающее в пептидогликановом слое, и L, находящееся во внешней мембране. Через все кольца проходит жёсткий стержень, передающий вращающий момент на филамент[39].
При сборке жгутика сначала в мембране клетки появляется MS-кольцо, к которому прикрепляются моторные белки, далее формируются P- и L-кольца (у грамотрицательных бактерий), крючок и филамент. В такой же последовательности запускается экспрессия генов, кодирующих белки соответствующей части жгутика[40]. Через полое внутреннее пространство базального тела новые флагеллиновые субъединицы поступают к вершине растущего жгутика, где самоорганизуются по спирали. Чтобы субъединицы флагеллина не уходили во внешнюю среду, конец растущего филамента прикрыт «шапочкой», которая не даёт им покинуть жгутик. В среднем зрелый филамент состоит из около 20 тысяч молекул флагеллина, а белки жгутика кодируются более чем 30 генами[41].
Вероятно, движущей силой вращения жгутика у бактерий является протонный градиент. Поток протонов, проходящий через кольца M и S или между базальным телом и клеточной мембраной, запускает вращение жгутика[42].
Движение клетки происходит за счёт вращения жгутика по часовой стрелке или против неё. У монотрихов клетка медленно вращается в направлении, противоположном вращению жгутика. Если жгутик вращается по часовой стрелке, то клетка движется жгутиком вперёд, а если против, то клетка выталкивается жгутиком вперёд (то есть движется жгутиком назад). Некоторые бактерии, имеющие единственный жгутик, вращают его только по часовой стрелке, и, чтобы сменить направление движения, им нужно остановиться и переориентироваться. У перитрихов жгутики вращаются против часовой стрелки, и, если нужно сменить направление движения, клетка останавливается и совершает кувырок[42].
У некоторых бактерий рода Vibrio (в частности, Vibrio parahaemolyticus[англ.][43]) и некоторых протеобактерий, таких как Aeromonas, имеются две различные жгутиковые системы, белковые компоненты которых кодируются различными наборами генов, а для вращения используются разные ионные градиенты. Полярные жгутики, относящиеся к первой жгутиковой системе, присутствуют постоянно и обеспечивают подвижность в потоке жидкости, а боковые жгутики, относящиеся ко второй жгутиковой системе, экспрессируются только тогда, когда сопротивление окружающей жидкости так велико, что полярные жгутики не могут вращаться. Благодаря этому бактерии могут скользить по различным поверхностям и в вязкой жидкости[44][45][46][47][48][49].
Пили

Пили (также известны как фимбрии или ворсинки) — нитевидные белковые структуры, расположенные на поверхности клеток многих бактерий. Размер пилей варьирует от долей мкм до более чем 20 мкм в длину и 2—11 нм в диаметре. Пили участвуют в передаче генетического материала между бактериальными клетками (конъюгация), прикреплении бактерий к субстрату и другим клеткам, отвечают за адаптацию организмов, служат местами прикрепления многих бактериофагов. Структурно пили могут быть от тонких нитевидных образований до толстых палочкообразных структур с осевыми отверстиями. Пили состоят из одного или нескольких типов спирально уложенных белковых молекул, которые называют пилинами[англ.] или фимбринами[50]. В образовании пилей, помимо самих белков-пилинов, участвуют дополнительные белки, способствующие правильной сборке. У грамотрицательных бактерий они должны пройти через клеточную мембрану, периплазматическое пространство и наружную мембрану[51].
Прочие внеклеточные структуры
Иногда слизистая структура окружает не отдельную клетку, как в случае капсулы, а скопление клеток, и тогда покровную слизистую структуру называют чехлом. Чехлы могут покрывать не только вегетативные клетки, но и другие варианты дифференцированных клеток, например, покоящиеся структуры (цисты, эндоспоры, гетероцисты). Чехлы имеются, например, у внутриклеточных паразитических[англ.] хламидий и цианобактерий[52].
У некоторых грамотрицательных бактерий, в частности, цианобактерий, псевдомонад[англ.], метилотрофных бактерий, имеются особые поверхностные полые белковые структуры — шипы. Шипы представляют собой жёсткие полые конические или конусообразно-цилиндрические структуры, которые прикреплены к наружной мембране. В среднем на клетку приходится 10 шипов. Диаметр шипов составляет 50—100 нм, длина — 0,5—3 мкм. Стенка шипа толщиной около 7 нм образована спирально уложенными молекулами белка спинина. Конусообразно-цилиндрические шипы имеют открытый конец, у конических конец запечатан. Шипы образуются путём самосборки. Их функции неясны, возможно, шипы задействованы в образовании микроколоний, прикреплении к субстратам и клеткам, защите от фаготрофных протистов[53].
У бактерии Bacillus vesiculiferous, которая живёт в бедном кислородом кишечнике рачков, и некоторых других бактерий имеются так называемые газовые баллоны — крупные структуры, наполненные газом и прикреплённые к поверхности клетки. Они представляют собой сферические, цилиндрические или игольчатые везикулы, стенка которой представлена мембраной толщиной около 2 нм. Вероятно, газовые баллоны служат для запасания кислорода[54].
У бактерий из типа Фирмикуты, способных к ферментативному разрушению целлюлозы, соответствующие ферменты — целлюлазы — находятся в особой структуре, целлюлосоме, которая находится в экзоплазматическом компартменте. Целлюлосома — очень крупный (от 2 тысяч до 6,5 тысяч кДа) белковый комплекс, состоящий из 14—26 белков. Целлюлосома способствует прикреплению бактерий к субстрату, обеспечивает оптимальное взаимодействие с ним целлюлаз и поступление продуктов гидролиза целлюлозы к поверхности клетки[55].
У некоторых цианобактерий в экзоплазматическом компартменте формируются кристаллы минералов, например, кальцита (CaCO3)[56].
Внутриклеточные структуры
Нуклеоид и плазмиды

Нуклеоид — зона неправильной формы в цитоплазме прокариотической (в том числе бактериальной) клетки, в которой находится геномная ДНК и ассоциированные с ней белки. На долю ДНК приходится около 60 % массы нуклеоида; помимо ДНК, нуклеоид содержит РНК и белки[57]. В большинстве случаев геном бактерии представлен кольцевой молекулой ДНК[англ.], которую также называют хромосомой. Как правило, бактериальная хромосома имеет длину около 1 мм, она занимает до 20 % цитоплазмы и имеет объём около 0,2 мкм³. Репликация геномной ДНК начинается от участка инициации (origin of chromosomal replication, oriC), из которого две репликативные вилки движутся в противоположных направлениях и встречаются в сайте терминации (Ter), в котором далее происходит размыкание сцепленных дочерних хромосом[].
Количество хромосом в бактериальной клетке зависит не только от видовой принадлежности, но и от фазы развития популяции. В качестве бактерий, постоянно имеющих несколько хромосом, можно привести Deinococcus radiodurans (от 4 до 10 хромосом), Borrelia hermsii[англ.] (от 8 до 16 хромосом), Desulfovibrio gigas (от 9 до 17 хромосом), Azotobacter vinelandii (до 80 хромосом). Молодые клетки обычно содержат больше хромосом, чем старые. Иногда хромосомы представляют не просто копии геномной ДНК: в некоторых случаях геном распределяется между несколькими неодинаковыми хромосомами и внехромосомными элементами (плазмидами). Так, у Agrobacterium tumefaciens, Brucella melitensis и Rhodobacter sphaeroides[англ.] имеются две разные хромосомы, а у Bacillus cereus, Leptospira interrogans[англ.] и Rhizobium meliloti[англ.], кроме хромосом, есть одна или две мегаплазмиды, состоящие из 100—500 тысяч пар оснований (п. о.)[58].
За компактизацию бактериальной хромосомы отвечают несколько разнородных белков, из которых наиболее важны HU, H-NS и SMC. Белки HU и H-NS называют гистоноподобными, их взаимодействие с ДНК зависит от её последовательности, наличия в молекуле шпилек и изгибов. Выявлены также минорные гистоноподобные белки FIS и IHF, которые, наряду с HU и H-NS, не только обеспечивают пространственную организацию бактериальной геномной ДНК, но также влияют на её репликацию, рекомбинацию и экспрессию генов. HU, совместно с ДНК-гиразой, обеспечивает отрицательную сверхспирализацию ДНК. H-NS компактизует ДНК, влияет на её сверхспирализацию, вызывает в ней изгибы, однако по большей части он задействован в экспрессии генов: под его контролем находятся до 40 генов. Белки SMC имеются у представителей всех трёх доменов жизни. Они гомологичны миозину, у эукариот они играют роль моторов при конденсации хроматина[59].
Плазмиды — это стабильные элементы внехромосомной ДНК, которые не являются строго необходимыми для функционирования бактериальной клетки. Гены, содержащиеся на плазмидах, дают своим обладателям полезные свойства, увеличивающие их приспособленность, — например, гены, отвечающие за производство антибиотиков и устойчивость к ним; гены, повышающие устойчивость к тяжёлым металлам и УФ-излучению; гены, кодирующие все компоненты, необходимые для конъюгации[60].
Рибосомы
Как и у других клеток, рибосома у бактерий состоит из большой и малой субъединиц, имеющих коэффициенты седиментации 50S и 30S (молекулярная масса 1,5 тысячи кДа и 750 кДа соответственно). В состав большой субъединицы входят две молекулы рибосомальной РНК (23S и 5S) и 34 белка (L1—L34). Малая субъединица состоит из одной молекулы рРНК — 16S рРНК, а также 21 белка (S1—S21). Молекула 23S рРНК весит 1000 кДа, 16S рРНК — 500 кДа, 5S рРНК — 40 кДа. За исключением L7 и L12, все рибосомные белки входят в состав рибосомы и представлены одной копией. Они имеют массу от 5 до 60 кДа и состоят из 45—555 аминокислотных остатков[61].
Гены рРНК объединены в один или несколько оперонов, находящихся в геномной ДНК, причём они всегда идут в порядке 16S—23S—5S. Иногда гены рРНК разделены спейсерами, в состав которых могут входить гены, кодирующие сериновые, глутаматные и изолейциновые тРНК. рРНК транскрибируются в составе одного транскрипта, который подвергается процессингу, заключающемуся в разрезании на отдельные рРНК рибонуклеазой Е[англ.] и метилировании. рРНК выступают молекулярным каркасом рибосомных субъединиц, и к ним в строгой последовательности присоединяются рибосомные белки. При интенсивном росте в клетках Escherichia coli находится около ста тысяч рибосом, причём до половины энергетических ресурсов клетки тратится на их биосинтез; на долю рРНК приходится 70 % всей клеточной РНК, а рибосомные белки составляют 30 % всех белков клетки[61].
Цитоскелет

Долгое время считалось, что у прокариот цитоскелета нет, однако с начала 1990-х годов стали накапливаться данные о наличии у прокариот разнообразных филаментов[63]. У прокариот не только имеются аналоги ключевых белков цитоскелета эукариот, но и белки, не имеющие аналогов у эукариот[64][65][66][67]. Элементы цитоскелета играют важные роли в делении клеток, защите, поддержании формы и определении полярности у различных прокариот[68][69]. Примерами белков цитоскелета прокариот могут служить такие белки, как FtsZ[англ.], гомологичный эукариотическому тубулину[70], необходимый для цитокинеза и действующий подобно актино-миозиновому сократительному кольцу эукариот[71]; MreB, соответствующий эукариотическому актину[72]; кресцентин, аналогичный белкам промежуточных филаментов эукариот[9].
Тельца включения
В клетках многих бактерий обнаруживаются небольшие гранулы разнообразных соединений — полисахаридов, поли-β-гидроксибутирата, полифосфатов, серы — в химически инертной форме. Большинство включений обеспечивают клетки энергией и необходимыми элементами в неблагоприятных условиях. Некоторые гранулы окружены тонкой мембраной толщиной от 2 до 4 нм; обычно такая мембрана имеет белковую природу, но иногда содержит и липиды. Гранулы полифосфатов также называют гранулами волютина, они являются запасным источником фосфата, необходимого для синтеза нуклеотидов. Бактерии, использующие серу в своём метаболизме, содержат в цитоплазме гранулы элементарной серы, окружённые однослойной белковой мембраной. Цианобактерии запасают цианофицин[англ.], который в условиях азотного голодания служит источником этого элемента[73]. Цианофицин представляет собой полипептид с молекулярной массой от 25 до 125 кДа, который, кроме цианобактерий, синтезируется и некоторыми другими группами бактерий, как, например, ацинетобактеры[74].
Многие бактерии содержат полиглюкозидные гранулы, состоящие из нерастворимых полиглюкозидов молекулярной массой до 200 кДа. Полиглюкозиды бактерий представляют собой разветвлённые цепочки из остатков глюкозы, аналогичные гликогену животных. У цианобактерии Prochloron didemni запасается аналог растительного крахмала[75]. У многих бактерий в цитоплазме содержатся полигидроксиалканоатные гранулы, которые выступают эндогенным источником углерода или энергии. Пилигидроксиалканоаты представляют собой сложные эфиры 3-, 4- или 5-гидроксикарбоновых кислот; они окружены белковой мембраной[76].
В редких случаях в цитоплазме бактерий обнаруживаются гидрофильные кристаллы, не окружённые мембраной. Гигантская серная бактерия Achromatium oxaliferum имеет цитоплазматические кристаллы кальцита (карбоната кальция), которые занимают более 70 % её объёма. Вероятно, именно благодаря им бактерия имеет крупные размеры, так как многочисленные гранулы обеспечивают приемлемую интенсивность транспортных процессов. Некоторые анаэробные бактерии, например, Sulfospirillum barnesii, содержат кристаллы элементарного селена диаметром до 200 нм. Они образуются в результате восстановления ядовитого иона селенита SeO32-.
Некоторые α-протеобактерии, такие как Erythrobacter litoralis[англ.] и несколько представителей рода Erythromicrobium[англ.], могут восстанавливать ион теллурита TeO32- до элементарного теллура, который в виде игольчатых кристаллов накапливается у них в цитоплазме. У ряда бактерий, таких как Rhodopseudomonas palustris[англ.] и Halococcus morrhuae[англ.], в цитоплазме имеются неокружённые мембраной магниточувствительные кристаллы железа (в магнитосомах кристаллы железа окружены мембраной). На одной из промежуточных стадий спорообразования у некоторых бацилл в цитоплазме материнской клетки образуются кристаллы диаметром от 0,1 до 1,5 мкм, состоящие из δ-эндотоксина, имеющего белковую природу и смертельного для личинок некоторых насекомых[77]. Эти кристаллы называются параспоральными гранулами[78].
Специализированные внутриклеточные структуры
Карбоксисомы

Эти органеллы обнаружены у всех цианобактерий и многих хемотрофных бактерий, фиксирующих CO2[79]. Карбоксисомы содержат фиксирующие углерод ферменты[80]. Они представляют собой многогранные однослойные белковые тела полиэдрической формы от 80 до 140 нм в диаметре. Они являются основной частью механизма концентрирования CO2, что помогает преодолеть неэффективность рибулозодифосфаткарбоксилазы (Рубиско) — главного фермента, фиксирующего углерод в цикле Кальвина.
Существует два вида карбоксисом: α-карбоксисомы и β-карбоксисомы, которые отличаются по своему белковому составу. В α-карбоксисомах содержится Рубиско I типа, которая распределена несколькими слоями, а гены, ответственные за синтез белков карбоксисомы, организованы в один оперон. В β-карбоксисомах содержится Рубиско II типа, у которой нет малых регуляторных субъединиц и которая организована в плотную паракристаллическую структуру при помощи специального белка, а её гены образуют несколько независимых кластеров[81].
Магнитосомы

Магнитосомы представляют собой окружённый мембраной цельный кристалл химически чистого магнетита (Fe3O4) или грейгита (Fe3S4). Бактерии, обладающие магнитосомами, способны к магнитотаксису — движению, связанному с реакцией клетки на магнитное поле (их называют магнитотактическими бактериями). Мембрана магнитосомы представляет собой фосфолипидный бислой, и некоторые её белки больше нигде не встречаются[82]. Как правило, магнитосомы образуют продольную цепочку, реже они собраны в 2 или 3 параллельные или пересекающиеся цепочки. Некоторые бактерии имеют единичные магнитосомы. Бактерии, имеющие магнитосомы, обитают в морских, речных и озёрных донных илах, на песчаных пляжах, рисовых полях и в затапливаемых почвах. По типу метаболизма они — хемоорганотрофные микроаэрофилы или анаэробы[83].
Хлоросомы

Хлоросомами называют фотосинтетические антенные комплексы зелёных серных бактерий и некоторых зелёных нитчатых аноксигенных фототрофов из типа Chloroflexi[англ.]. От других антенных комплексов они отличаются крупными размерами и отсутствием белкового матрикса вокруг фотосинтетических пигментов[англ.][84]. Хлоросомы могут иметь эллипсоидную, коническую или неправильную форму[85]. Специальные белки заякоривают хлоросомы вблизи фотосинтетических реакционных центров на клеточной мембране[86]. Хлоросомы состоят из бактериохлорофилла с небольшими вкраплениями каротиноидов и хинонов и окружены галактолипидным[англ.] монослоем[87].
Газовые везикулы
У многих водных бактерий, особенно цианобактерий, имеются газовые везикулы, которые служат для регуляции плавучести. Мембрана, ограничивающая газовую везикулу, имеет белковую природу, а внутри газовой везикулы находится атмосферный воздух. Газовые везикулы располагаются в цитоплазме поодиночке или образуют сотовидные скопления, которые иногда неправильно называют газовыми вакуолями. Газовые везикулы представляют собой полые цилиндры с коническими концами диаметром 50—200 нм и длиной 100—1200 нм. Стенка имеет толщину около 2 нм и представляет собой однослойную белковую мембрану, состоящую из двух гомологичных гидрофобных белков. В биогенезе газовых везикул задействовано до 15 генов, расположенных в геномной ДНК или на плазмидах; их обозначают gvp от англ. gas vesicle protein. Около 90 % твёрдого вещества газовой везикулы приходится на белок GvpA. Белки Gvp отличаются высокой консервативностью[88].
Мезосомы

В 1953 году на электронно-микроскопических препаратах бактериальных клеток были обнаружены специфические впячивания клеточной мембраны, которым впоследствии дали название «мезосома». Высказывались предположения, что мезосомы могут участвовать в формировании клеточной стенки при делении клетки, репликации геномной ДНК или же на них протекает окислительное фосфорилирование[89][90]. Однако уже спустя 20 лет накопились данные, свидетельствующие, что мезосомы есть артефакт химической фиксации клеток при подготовке препаратов для электронной микроскопии и что они отсутствуют у клеток, не подвергавшихся химической фиксации[91][92]. Впоследствии структуры, похожие на мезосомы, были найдены в клетках бактерий, подвергшихся действию антибиотиков[93] или антимикробных пептидов дефензинов[94]. Вероятно, образование мезосом в этом случае вызвано разрушением клеточной мембраны и/или клеточной стенки под действием антибиотиков[95].
Прочие внутриклеточные структуры
Изредка в бактериальных клетках встречаются вакуоли. У представителей родов Beggiatoa, Thiomargarita и Thioploca основная часть объёма клетки занята большой вакуолью, накапливающей ионы нитрата. Они используют нитрат в качестве терминального акцептора электронов при анаэробном окислении сульфида, при этом нитрат восстанавливается до молекулярного азота или аммиака. У некоторых бактерий, родственных Beggiatoa, аналогичные вакуоли служат для накопления другого конечного акцептора электронов — кислорода. У некоторых планктомицетов имеется крупная анаммоксосома. Эта вакуоль запасает энергию путём анаэробного окисления аммиака (анаммокса), где ионы нитрита служат в качестве акцептора электронов. Мембрана анаммоксосомы состоит из уникальных липидов, известных как ледераны. Они состоят из восьмиуглеродной линейной цепи, к которой присоединена «лестница» (отсюда их название) из пяти циклобутановых остатков или трёх циклобутановых остатков и одного циклогексанового остатка. В мембране анаммоксосомы содержится АТФ-синтаза, которая синтезирует АТФ, запасая энергию, выделяющуюся при движении протонов по градиенту концентрации — из анаммоксосомы в цитоплазму[96].
В клетках Agrobacterium tumefaciens содержатся пирофосфатные гранулы, окружённые мембраной. Такие тельца называются ацидокальдосомы, и, кроме бактерий, они описаны у некоторых паразитических протистов. В мембране ацидокальдосомы имеется протонная пирофосфатаза[англ.], переносящая протоны внутрь органеллы, гидролизуя цитоплазматический пирофосфат. Вероятно, внутри ацидокальдосомы находится полифосфаткиназа[англ.], синтезирующая пирофосфат, кроме того, в ней должен проходить АТФ[97].
У многих нитчатых цианобактерий имеются керитомические вакуоли, которые имеют сферическую форму, кристаллическое или аморфное содержимое и окружены мембраной. Скорее всего, в них запасаются органические вещества. Функции керитомических вакуолей неизвестны; возможно, они изолируют вредные продукты метаболизма[97].
Дифференцированные бактериальные клетки
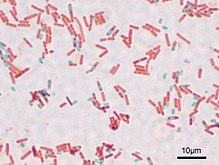
Многие бактерии способны образовывать особые покоящиеся формы, предназначенные для переживания неблагоприятных условий. Многие грамположительные бактерии, а именно представители родов Bacillus, Sporolactobacillus[англ.], Clostridium, Desulfotomaculum[англ.], Sporosarcina[англ.] и Thermoactinomyces, формируют эндоспоры. У всех этих бактерий имеется очень толстая клеточная стенка, которая, по-видимому, необходима для спорообразования. Эндоспоры имеют однотипную структуру и чаще всего гладкие, яйцевидные. Сверху спора покрыта экзоспориумом, под ним лежит многослойная оболочка споры, которая практически не проницаема для химических веществ. Под оболочкой залегает кортекс, под которым находится мембрана споры, окружающая протопласт. Протопласт споры содержит нуклеоид и рибосомы. Споры чрезвычайно устойчивы к действию не только химических веществ, но также УФ-излучению, нагреванию и высушиванию и могут сохранять жизнеспособность много тысяч лет[98].
Споруляция (процесс образования спор) запускается неблагоприятными факторами окружающей среды. В клетке образуются впячивания клеточной мембраны, которые, смыкаясь, разделяют её септой на две части. Меньшая из них превращается в эндоспору, наращивает кортекс и многослойную оболочку. В конце концов материнская клетка погибает, и эндоспора, генетически идентичная материнской клетке, выходит наружу. Таким образом, вегетативная клетка может дать начало только одной эндоспоре, поэтому образование эндоспор не является способом размножения. Прорастание споры происходит в благоприятных условиях. После активации начинаются созревание и прорастание споры, в результате которых клетка покидает споровые оболочки и выходит во внешнюю среду[99].
Под цистами понимают умеренно покоящиеся и слаборезистентные клетки, которые образуются непосредственно путём бинарного деления или дробления (то есть не в результате спорообразования). Цисты характеризуются пониженной метаболической активностью, повышенной устойчивостью по крайней мере к одному неблагоприятному фактору окружающей среды, наличием защитных покровов, которых нет у вегетативных клеток и накоплением запасных включений. При попадании в подходящие условия цисты дедифференцируются и начинают расти и размножаться. У патогенов цисты могут передаваться от хозяина к хозяину[100]. Цисты образуют актинобактерии, миксобактерии, цианобактерии, метанотрофные бактерии, бактерии рода Azotobacter[101].
Цианобактерии образуют специализированные структуры и клетки, предназначенные для размножения и расселения. К их числу относятся особые клетки — беоциты, образуемые плеврокапсовыми цианобактериями. Беоциты в два раза меньше по объёму, чем материнские клетки, и образуются в результате её дробления, а не бинарного деления[101].

Также у цианобактерий описаны гормогонии — короткие нитевидные структуры, состоящие из клеток, существенно меньших в размерах, чем обычные вегетативные клетки, и отличающиеся от них по форме. В клетках гормогония часто содержатся газовые везикулы. В гормогониях или обычных вегетативных нитях цианобактерий при азотном голодании могут появляться особые дифференцированные клетки — гетероцисты, в которых содержится фермент нитрогеназа, фиксирующая атмосферный азот. Когда в гетероцисте появляется активность нитрогеназы, она не может дедифференцироваться и в конце концов стареет и погибает[101].
У бактерий, формирующих азотфиксирующие клубеньки на корнях бобовых растений (например, видов рода Rhizobium), могут появляться дифференцированные клетки, известные как бактероиды. Бактероиды в несколько раз превосходят вегетативные клетки по объёму, они часто имеют специфическую X- или Y-образную форму. В зрелых бактероидах 10—12 % клеточного белка приходится на нитрогеназу[101].
Примечания
- ↑ Нетрусов, Котова, 2012, с. 31.
- ↑ Пиневич, 2006, с. 157—159.
- ↑ Young K. D. The selective value of bacterial shape. (англ.) // Microbiology And Molecular Biology Reviews : MMBR. — 2006. — September (vol. 70, no. 3). — P. 660—703. — doi:10.1128/MMBR.00001-06. — PMID 16959965.
- ↑ Нетрусов, Котова, 2012, с. 35—36.
- ↑ Jiang C., Brown P. J., Ducret A., Brun Y. V. Sequential evolution of bacterial morphology by co-option of a developmental regulator. (англ.) // Nature. — 2014. — 27 February (vol. 506, no. 7489). — P. 489—493. — doi:10.1038/nature12900. — PMID 24463524.
- ↑ Koch A. L. Control of the bacterial cell cycle by cytoplasmic growth. (англ.) // Critical Reviews In Microbiology. — 2002. — Vol. 28, no. 1. — P. 61—77. — doi:10.1080/1040-840291046696. — PMID 12003041.
- ↑ Benjamin Lewin. Chapter 13: The replicon // Genes VIII. — Upper Saddle River, NJ: Pearson Prentice Hall, 2004. — ISBN 0131439812.
- ↑ de Boer P. A. Advances in understanding E. coli cell fission. (англ.) // Current Opinion In Microbiology. — 2010. — December (vol. 13, no. 6). — P. 730—737. — doi:10.1016/j.mib.2010.09.015. — PMID 20943430.
- ↑ 1 2 Ausmees N., Kuhn J. R., Jacobs-Wagner C. The bacterial cytoskeleton: an intermediate filament-like function in cell shape. (англ.) // Cell. — 2003. — Vol. 115, no. 6. — P. 705—713. — PMID 14675535.
- ↑ EAGON RG. Pseudomonas natriegens, a marine bacterium with a generation time of less than 10 minutes. (англ.) // Journal Of Bacteriology. — 1962. — April (vol. 83). — P. 736—737. — PMID 13888946.
- ↑ Пиневич, 2006, с. 181—182.
- ↑ Пиневич, 2006, с. 170—177.
- ↑ 1 2 Нетрусов, Котова, 2012, с. 54.
- ↑ Joseleau-Petit D., Liébart J. C., Ayala J. A., D'Ari R. Unstable Escherichia coli L forms revisited: growth requires peptidoglycan synthesis. (англ.) // Journal Of Bacteriology. — 2007. — September (vol. 189, no. 18). — P. 6512—6520. — doi:10.1128/JB.00273-07. — PMID 17586646.
- ↑ Куранова, Купатадзе, 2013, с. 29.
- ↑ Razin S., Yogev D., Naot Y. Molecular biology and pathogenicity of mycoplasmas. (англ.) // Microbiology And Molecular Biology Reviews : MMBR. — 1998. — December (vol. 62, no. 4). — P. 1094—1156. — PMID 9841667.
- ↑ 1 2 3 Нетрусов, Котова, 2012, с. 48.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 928.
- ↑ Jacquelyn G. Black, Laura J. Black. Microbiology: Principles and Explorations, 9th Edition. — Wiley, 2014. — С. 85. — 960 с. — ISBN 978-1-118-74316-4.
- ↑ 1 2 Кассимерис, Лингаппа, Плоппер, 2016, с. 925.
- ↑ Нетрусов, Котова, 2012, с. 51.
- ↑ 1 2 Современная микробиология, 2005, с. 51.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 929—930.
- ↑ Нетрусов, Котова, 2012, с. 49, 51.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 930—931.
- ↑ 1 2 Green E. R., Mecsas J. Bacterial Secretion Systems: An Overview. (англ.) // Microbiology Spectrum. — 2016. — February (vol. 4, no. 1). — doi:10.1128/microbiolspec.VMBF-0012-2015. — PMID 26999395.
- ↑ Современная микробиология, 2005, с. 52.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 932.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 932—933.
- ↑ 1 2 Нетрусов, Котова, 2012, с. 52.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 933—934.
- ↑ Нетрусов, Котова, 2012, с. 51—52.
- ↑ Пиневич, 2006, с. 255—256.
- ↑ Пиневич, 2006, с. 257.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 926—928.
- ↑ Пиневич, 2006, с. 302—303.
- ↑ Пиневич, 2006, с. 291—293.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 940—941.
- ↑ Нетрусов, Котова, 2012, с. 61.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 941.
- ↑ Нетрусов, Котова, 2012, с. 61—62.
- ↑ 1 2 Нетрусов, Котова, 2012, с. 64.
- ↑ Kim Y. K., McCarter L. L. Analysis of the polar flagellar gene system of Vibrio parahaemolyticus. (англ.) // Journal Of Bacteriology. — 2000. — July (vol. 182, no. 13). — P. 3693—3704. — PMID 10850984.
- ↑ Atsumi T., Maekawa Y., Yamada T., Kawagishi I., Imae Y., Homma M. Effect of viscosity on swimming by the lateral and polar flagella of Vibrio alginolyticus. (англ.) // Journal Of Bacteriology. — 1996. — August (vol. 178, no. 16). — P. 5024—5026. — PMID 8759871.
- ↑ McCarter L. L. Dual flagellar systems enable motility under different circumstances. (англ.) // Journal Of Molecular Microbiology And Biotechnology. — 2004. — Vol. 7, no. 1-2. — P. 18—29. — doi:10.1159/000077866. — PMID 15170400.
- ↑ Merino S., Shaw J. G., Tomás J. M. Bacterial lateral flagella: an inducible flagella system. (англ.) // FEMS Microbiology Letters. — 2006. — October (vol. 263, no. 2). — P. 127—135. — doi:10.1111/j.1574-6968.2006.00403.x. — PMID 16978346.
- ↑ Belas R., Simon M., Silverman M. Regulation of lateral flagella gene transcription in Vibrio parahaemolyticus. (англ.) // Journal Of Bacteriology. — 1986. — July (vol. 167, no. 1). — P. 210—218. — PMID 3013835.
- ↑ Canals R., Altarriba M., Vilches S., Horsburgh G., Shaw J. G., Tomás J. M., Merino S. Analysis of the lateral flagellar gene system of Aeromonas hydrophila AH-3. (англ.) // Journal Of Bacteriology. — 2006. — February (vol. 188, no. 3). — P. 852—862. — doi:10.1128/JB.188.3.852-862.2006. — PMID 16428388.
- ↑ Canals R., Ramirez S., Vilches S., Horsburgh G., Shaw J. G., Tomás J. M., Merino S. Polar flagellum biogenesis in Aeromonas hydrophila. (англ.) // Journal Of Bacteriology. — 2006. — January (vol. 188, no. 2). — P. 542—555. — doi:10.1128/JB.188.2.542-555.2006. — PMID 16385045.
- ↑ Нетрусов, Котова, 2012, с. 54—56.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 939—940.
- ↑ Пиневич, 2006, с. 305—306.
- ↑ Пиневич, 2006, с. 307—308.
- ↑ Пиневич, 2006, с. 308.
- ↑ Пиневич, 2006, с. 309—310.
- ↑ Пиневич, 2006, с. 311.
- ↑ Нетрусов, Котова, 2012, с. 37—38.
- ↑ Пиневич, 2006, с. 194—195.
- ↑ Пиневич, 2006, с. 196—197.
- ↑ Кассимерис, Лингаппа, Плоппер, 2016, с. 943.
- ↑ 1 2 Пиневич, 2006, с. 205.
- ↑ Gitai Z. The new bacterial cell biology: moving parts and subcellular architecture. (англ.) // Cell. — 2005. — Vol. 120, no. 5. — P. 577—586. — doi:10.1016/j.cell.2005.02.026. — PMID 15766522.
- ↑ Bi E. F., Lutkenhaus J. FtsZ ring structure associated with division in Escherichia coli. (англ.) // Nature. — 1991. — Vol. 354, no. 6349. — P. 161—164. — doi:10.1038/354161a0. — PMID 1944597.
- ↑ Gunning P. W., Ghoshdastider U., Whitaker S., Popp D., Robinson R. C. The evolution of compositionally and functionally distinct actin filaments. (англ.) // Journal of cell science. — 2015. — Vol. 128, no. 11. — P. 2009—2019. — doi:10.1242/jcs.165563. — PMID 25788699.
- ↑ Popp D., Narita A., Lee L. J., Ghoshdastider U., Xue B., Srinivasan R., Balasubramanian M. K., Tanaka T., Robinson R. C. Novel actin-like filament structure from Clostridium tetani. (англ.) // The Journal of biological chemistry. — 2012. — Vol. 287, no. 25. — P. 21121—21129. — doi:10.1074/jbc.M112.341016. — PMID 22514279.
- ↑ Popp D., Narita A., Ghoshdastider U., Maeda K., Maéda Y., Oda T., Fujisawa T., Onishi H., Ito K., Robinson R. C. Polymeric structures and dynamic properties of the bacterial actin AlfA. (англ.) // Journal of molecular biology. — 2010. — Vol. 397, no. 4. — P. 1031—1041. — doi:10.1016/j.jmb.2010.02.010. — PMID 20156449.
- ↑ Wickstead B., Gull K. The evolution of the cytoskeleton. (англ.) // The Journal of cell biology. — 2011. — Vol. 194, no. 4. — P. 513—525. — doi:10.1083/jcb.201102065. — PMID 21859859.
- ↑ Shih Y. L., Rothfield L. The bacterial cytoskeleton. (англ.) // Microbiology and molecular biology reviews : MMBR. — 2006. — Vol. 70, no. 3. — P. 729—754. — doi:10.1128/MMBR.00017-06. — PMID 16959967.
- ↑ Michie K. A., Löwe J. Dynamic filaments of the bacterial cytoskeleton. (англ.) // Annual review of biochemistry. — 2006. — Vol. 75. — P. 467—492. — doi:10.1146/annurev.biochem.75.103004.142452. — PMID 16756499.
- ↑ Desai A., Mitchison T. J. Tubulin and FtsZ structures: functional and therapeutic implications. (англ.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 1998. — Vol. 20, no. 7. — P. 523—527. — doi:10.1002/(SICI)1521-1878(199807)20:7<523::AID-BIES1>3.0.CO;2-L. — PMID 9722999.
- ↑ Graumann P. L. Cytoskeletal elements in bacteria. (англ.) // Current opinion in microbiology. — 2004. — Vol. 7, no. 6. — P. 565—571. — doi:10.1016/j.mib.2004.10.010. — PMID 15556027.
- ↑ Gitai Z., Dye N., Shapiro L. An actin-like gene can determine cell polarity in bacteria. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2004. — Vol. 101, no. 23. — P. 8643—8648. — doi:10.1073/pnas.0402638101. — PMID 15159537.
- ↑ Нетрусов, Котова, 2012, с. 46—48.
- ↑ Krehenbrink Martin, Oppermann-Sanio Fred-Bernd, Steinbüchel Alexander. Evaluation of non-cyanobacterial genome sequences for occurrence of genes encoding proteins homologous to cyanophycin synthetase and cloning of an active cyanophycin synthetase from Acinetobacter sp. strain DSM 587 (англ.) // Archives of Microbiology. — 2002. — 1 May (vol. 177, no. 5). — P. 371—380. — ISSN 0302-8933. — doi:10.1007/s00203-001-0396-9.
- ↑ Пиневич, 2006, с. 230—231.
- ↑ Пиневич, 2006, с. 237—238.
- ↑ Пиневич, 2006, с. 232—233.
- ↑ Нетрусов, Котова, 2012, с. 46.
- ↑ Yeates T. O., Kerfeld C. A., Heinhorst S., Cannon G. C., Shively J. M. Protein-based organelles in bacteria: carboxysomes and related microcompartments. (англ.) // Nature reviews. Microbiology. — 2008. — Vol. 6, no. 9. — P. 681—691. — doi:10.1038/nrmicro1913. — PMID 18679172.
- ↑ Badger M. R., Price G. D. CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution. (англ.) // Journal of experimental botany. — 2003. — Vol. 54, no. 383. — P. 609—622. — PMID 12554704.
- ↑ Lee, R. E. Phycology, 4th edition. — Colorado State University, USA: Cambridge University Press, 2008. — P. 39. — 547 p. — ISBN 9780521682770. Архивировано 23 сентября 2016 года.
- ↑ Vargas G., Cypriano J., Correa T., Leão P., Bazylinski D. A., Abreu F. Applications of Magnetotactic Bacteria, Magnetosomes and Magnetosome Crystals in Biotechnology and Nanotechnology: Mini-Review. (англ.) // Molecules (Basel, Switzerland). — 2018. — 24 September (vol. 23, no. 10). — doi:10.3390/molecules23102438. — PMID 30249983.
- ↑ Пиневич, 2006, с. 233—235.
- ↑ Martinez-Planells A., Arellano J. B., Borrego C. M., López-Iglesias C., Gich F., Garcia-Gil J. Determination of the topography and biometry of chlorosomes by atomic force microscopy. (англ.) // Photosynthesis Research. — 2002. — Vol. 71, no. 1-2. — P. 83—90. — doi:10.1023/A:1014955614757. — PMID 16228503.
- ↑ Oostergetel Gert T., van Amerongen Herbert, Boekema Egbert J. The chlorosome: a prototype for efficient light harvesting in photosynthesis (англ.) // Photosynthesis Research. — 2010. — 4 February (vol. 104, no. 2-3). — P. 245—255. — ISSN 0166-8595. — doi:10.1007/s11120-010-9533-0.
- ↑ Linnanto Juha M., Korppi-Tommola Jouko E. I. Exciton Description of Chlorosome to Baseplate Excitation Energy Transfer in Filamentous Anoxygenic Phototrophs and Green Sulfur Bacteria (англ.) // The Journal of Physical Chemistry B. — 2013. — August (vol. 117, no. 38). — P. 11144—11161. — ISSN 1520-6106. — doi:10.1021/jp4011394.
- ↑ Orf Gregory S., Blankenship Robert E. Chlorosome antenna complexes from green photosynthetic bacteria (англ.) // Photosynthesis Research. — 2013. — 13 June (vol. 116, no. 2-3). — P. 315—331. — ISSN 0166-8595. — doi:10.1007/s11120-013-9869-3.
- ↑ Пиневич, 2006, с. 224—226.
- ↑ Suganuma A. Studies on the fine structure of Staphylococcus aureus. (англ.) // Journal Of Electron Microscopy. — 1966. — Vol. 15, no. 4. — P. 257—261. — PMID 5984369.
- ↑ Pontefract R. D., Bergeron G., Thatcher F. S. Mesosomes in Escherichia coli. (англ.) // Journal Of Bacteriology. — 1969. — January (vol. 97, no. 1). — P. 367—375. — PMID 4884819.
- ↑ Ebersold H. R., Cordier J. L., Lüthy P. Bacterial mesosomes: method dependent artifacts. (англ.) // Archives Of Microbiology. — 1981. — September (vol. 130, no. 1). — P. 19—22. — PMID 6796029.
- ↑ Higgins M. L., Tsien H. C., Daneo-Moore L. Organization of mesosomes in fixed and unfixed cells. (англ.) // Journal Of Bacteriology. — 1976. — September (vol. 127, no. 3). — P. 1519—1523. — PMID 821934.
- ↑ Santhana Raj L., Hing H. L., Baharudin O., Teh Hamidah Z., Aida Suhana R., Nor Asiha C. P., Vimala B., Paramsarvaran S., Sumarni G., Hanjeet K. Mesosomes are a definite event in antibiotic-treated Staphylococcus aureus ATCC 25923. (англ.) // Tropical Biomedicine. — 2007. — June (vol. 24, no. 1). — P. 105—109. — PMID 17568383.
- ↑ Friedrich C. L., Moyles D., Beveridge T. J., Hancock R. E. Antibacterial action of structurally diverse cationic peptides on gram-positive bacteria. (англ.) // Antimicrobial Agents And Chemotherapy. — 2000. — August (vol. 44, no. 8). — P. 2086—2092. — PMID 10898680.
- ↑ Balkwill D. L., Stevens Jr. S. E. Effects of penicillin G on mesosome-like structures in Agmenellum quadruplicatum. (англ.) // Antimicrobial Agents And Chemotherapy. — 1980. — March (vol. 17, no. 3). — P. 506—509. — PMID 6775592.
- ↑ Пиневич, 2006, с. 222—224.
- ↑ 1 2 Пиневич, 2006, с. 236.
- ↑ Нетрусов, Котова, 2012, с. 66—68.
- ↑ Нетрусов, Котова, 2012, с. 70—72.
- ↑ Нетрусов, Котова, 2012, с. 73.
- ↑ 1 2 3 4 Пиневич А. В. Микробиология. Биология прокариотов. — СПб.: Издательство С.-Петербургского университета, 2009. — Т. 3. — С. 240—257. — 457 с. — ISBN 978-5-288-04894-4.
Литература
- Пиневич А. В. Микробиология. Биология прокариотов: в 3 т. — СПб.: Издательство С.-Петербургского университета, 2006. — Т. 1. — 352 с. — ISBN 5-288-04057-5.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.
- Современная микробиология / Под ред. Й. Ленгелера, Г. Древса, Г. Шлегеля. — М.: Мир, 2005. — Т. 1. — 654 с.
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. . Клетки по Льюину. — М.: Лаборатория знаний, 2016. — 1056 с. — ISBN 978-5-906828-23-1.
- Куранова Н. Г., Купатадзе Г. А. Микробиология. Часть 1. Прокариотическая клетка. — М.: Прометей, 2013. — 108 с. — ISBN 978-5-7042-2459-4.