Аммонификáция — процесс разложения азотсодержащих органических соединений в результате их ферментативного гидролиза под действием аммонифицирующих микроорганизмов с образованием токсичных для человека конечных продуктов — аммиака, сероводорода, а также первичных и вторичных аминов при неполной минерализации продуктов разложения:
- трупных ядов, например: путресцин и кадаверин;
- ароматических соединений, например: скатол, индол — образуются в результате дезаминирования и декарбоксилирования аминокислоты триптофана;
- серосодержащих аминокислот, например: цистеина, цистина и метионина, — приводит к выделению сероводорода, тиолов, диметилсульфоксида.

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например, фотосинтетический комплекс и другие комплексы.
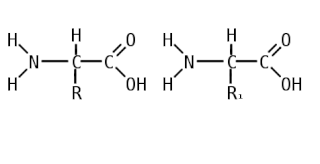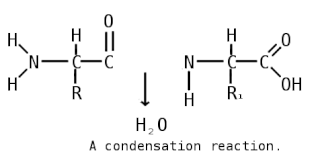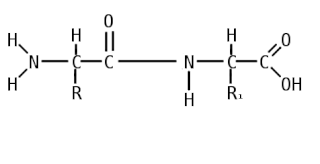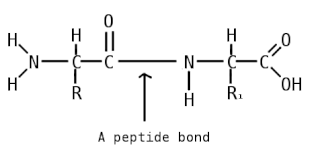
Пепти́ды — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями −C(O)NH−. Обычно подразумеваются пептиды, состоящие из  -аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.
-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.

Сери́н — гидроксиаминокислота, существует в виде двух оптических изомеров — L и D.

В биологии активный центр — это область фермента, где молекулы субстрата связываются и подвергаются химической реакции. Активный центр состоит из аминокислотных остатков, которые образуют временные связи с субстратом, и остатков, которые катализируют реакцию этого субстрата. Хотя активный центр занимает только ~ 10-20 % от объёма фермента он является наиболее важной частью, поскольку он непосредственно катализирует химическую реакцию. Обычно активный центр состоит из трех-четырех аминокислот, в то время как другие аминокислоты в белке необходимы для поддержания его третичной структуры.

Фури́н — фермент, сериновая протеаза клеток животных, расположенная в аппарате Гольджи. Фурин по структуре напоминает бактериальный протеолитический фермент субтилизин.

Кристиан Бемер Анфинсен — американский биохимик, член Национальной АН США, Американской академии искусств и наук (1958), иностранный член Датской королевской академии наук (1964). Лауреат Нобелевской премии по химии (1972).
Протеа́зы, протеиназы, протеолитические ферменты — ферменты из класса гидролаз, которые расщепляют пептидную связь —СО—NH— между аминокислотами в белках. Делятся на две группы:
- экзопротеазы — выделяются организмом во внешнюю среду ;
- эндопротеазы — находятся внутри клеток.
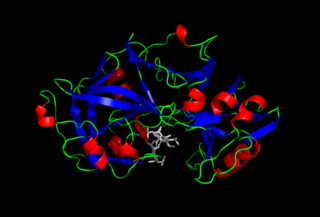
Пепси́н — протеолитический фермент класса гидролаз образуется из своего предшественника пепсиногена, вырабатываемого главными клетками слизистой оболочки желудка, и осуществляет расщепление белков пищи до пептидов. Присутствует в желудочном соке человека и других млекопитающих, птиц, пресмыкающихся и большинства рыб.
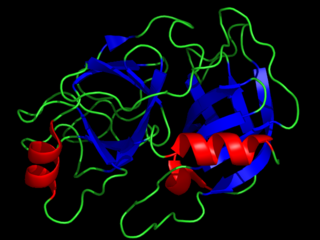
Трипсин — фермент класса гидролаз, расщепляющий пептиды и белки; обладает также эстеразной активностью.
Протеиназа K — сериновая протеаза широкого спектра. Обнаружена в 1974 году в экстракте грибка Engyodontium album.

Сериновые протеазы, также сериновые эндопептидазы — группа ферментов, катализирующих процесс деградации (протеолиз) белков на составлющие их молекулы α-аминокислот посредством гидролиза пептидной связи. Основное отличие от других протеаз — наличие в своём активном центре аминокислоты серина.

Протеолиз — процесс гидролиза белков, катализируемый ферментами пептидгидролазами, или протеазами.
Lon — сериновая протеаза в клетках бактерий, митохондриях и хлоропластах эукариот. Принадлежит к важной группе АТФ-зависимых протеаз, куда также относится протеасомы, ClpP, HslVU и FtsH. По классификации MEROPS относится к семейству S16.

Эмиль Л. Смит — американский биохимик, внесший значительный вклад в химию белка, развитие методов очистки, описания структуры и секвенирования ферментов. Первым указал на составную природу хлорофилла-белковых комплексов в зелёных растениях и постулировал необходимость ионов металлов для каталитической активности пептидаз.
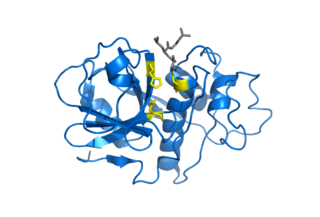
Цистеиновые протеазы, также известные, как цистеиновые эндопептидазы или тиоловые протеазы — группа протеолитических ферментов (эндопептидаз), расщепляющих белковые молекулы, на составляющие их аминокислоты, посредством гидролиза пептидной связи (протеолиза). В состав активного центра данных протеаз обязательно входит цистеин и их каталитическая активность зависит от сульфгидрильной или тиоловой группы (-SH-группа).
Протеаза TEV — высокоспецифичная цистеиновая протеаза вируса гравировки табака. Относится к суперсемейству PA из химотрипсин-подобных протеаз. Благодаря своей высокой специфичности к последовательности часто используется для контролируемого расщепления гибридных белков in vitro и in vivo.

Валенти́н Миха́йлович Степа́нов — советский и российский биохимик, преподаватель химического факультета МГУ, член-корреспондент Российской академии наук (1997).
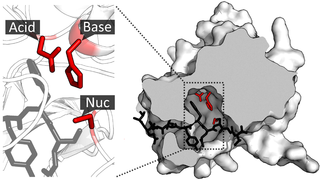
Каталитическая триада — это набор из трех скоординированных аминокислот, которые можно найти в активном центре некоторых ферментов. Каталитические триады чаще всего встречаются в ферментах гидролаз и трансфераз. Триада кислота-основание-нуклеофил является распространенным мотивом для образования нуклеофильного остатка для ковалентного катализа. Остатки образуют сеть реле заряда для поляризации и активации нуклеофила, который атакует субстрат, образуя ковалентный промежуточный продукт, который затем гидролизуется с высвобождением продукта и регенерацией свободного фермента. Нуклеофилом чаще всего является аминокислота серин или цистеин, но иногда треонин или даже селеноцистеин. Трехмерная структура фермента объединяет триадные остатки в точной ориентации, даже если они могут находиться далеко друг от друга в последовательности.

Кутиназа (Шифр КФ 3.1.1.74) — фермент, катализирующий химическую реакцию:
- Кутин + H2O
 Кутиновые мономеры
Кутиновые мономеры
















