
Соля́ная кислота́ — сильная неорганическая кислота. Раствор хлороводорода в воде.

Сульфа́т желе́за(II), желе́зо(II) серноки́слое — неорганическое соединение, железная соль серной кислоты с формулой FeSO4. Нелетуч, не имеет запаха. Безводное вещество бесцветное, непрозрачное, очень гигроскопичное. Кристаллогидраты — гигроскопичные прозрачные кристаллы светлого голубовато-зелёного, тетрагидрат FeSO4·4Н2О зелёного цвета (розенит), моногидрат FeSO4·Н2О бесцветный (смольнокит). Вкус сильно-вяжущий железистый (металлический). На воздухе постепенно выветриваются (теряют кристаллизационную воду). Сульфат железа(II) хорошо растворим в воде (26,3 г при 20 °С). Из водных растворов кристаллизуется голубовато-зелёный гептагидрат FeSO4·7Н2О, который носит тривиальное название железный купоро́с. Токсичность железного купороса сравнительно низкая.

Се́рная кислота́ (химическая формула — H2SO4) — сильная неорганическая кислота, отвечающая высшей степени окисления серы (+6).

Окси́д се́ры(VI) (се́рный ангидри́д, трёхо́кись се́ры, се́рный газ) — высший оксид серы. Ангидрид серной кислоты. В обычных условиях легколетучая бесцветная жидкость с удушливым запахом. Весьма токсичен. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.

Сульфа́т ма́гния, MgSO4 — неорганическое вещество, средняя соль магния и серной кислоты. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. Гигроскопичен. Образует ряд кристаллогидратов. В природе присутствует в морской воде и в виде минералов, таких как кизерит, эпсомит и гексагидрит. Впервые была найдена в воде эпсомского источника в Англии ботаником Неемией Грю в 1695 году. Получают главным образом методом дробной кристаллизации при выпаривании солей минеральных источников, а также твердых соляных отложений. Применяют как сырье для получения оксида магния в производстве магнезиальных цементов, в текстильной промышленности в качестве утяжелителя волокон и протравы при окрашивании тканей, в целлюлозно-бумажной промышленности как наполнитель бумаги, в медицине в качестве спазмолитического, желчегонного и слабительного лекарственного средства.

Марганцо́вая кислота́ — сильная, нестабильная, неорганическая кислота фиолетово-красного цвета с химической формулой  . В чистом виде не выделена, существует в виде раствора.
. В чистом виде не выделена, существует в виде раствора.

Хлори́д ме́ди(II) (медь хлорная) — бинарное неорганическое вещество, соединение меди с хлором, относящееся к классу галогенидов и солей (может рассматриваться как соль соляной кислоты и меди). Образует кристаллогидраты вида CuCl2·nH2O.
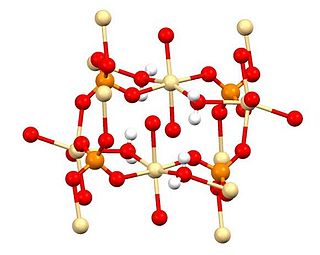
Сульфат кадмия (англ. Cadmium sulfate) — химическое вещество с формулой CdSO4. Преимущественно известно в форме гидрата 3CdSO4·8H2O. Очень редко встречается в природе в составе некоторых минералов.

Сульфа́т ма́рганца(II) — неорганическое соединение, соль металла марганца и серной кислоты с химической формулой  , хорошо растворимо в воде, образует кристаллогидраты.
, хорошо растворимо в воде, образует кристаллогидраты.

Сульфа́т ко́бальта(II) — неорганическое вещество с формулой CoSO4, является солью двухвалентного кобальта и серной кислоты. Безводный сульфат кобальта(II) представляет собой кристаллическое вещество розового цвета. Гептагидрат сульфата кобальта(II) CoSO4·7H2O имеет вид красных кристаллов и известен под названием «кобальтовый (красный) купорос». Встречается в природе в виде ряда минералов, применяется в качестве пигмента и при покрытии других металлов кобальтом.
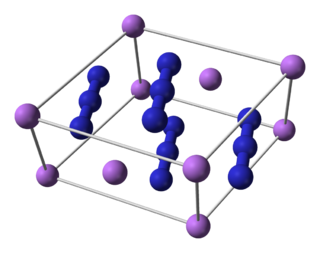
Ази́д ли́тия — неорганическое вещество с формулой LiN3, соль лития и азотистоводородной кислоты, белое гигроскопическое кристаллическое вещество, взрывоопасно. Образует кристаллогидрат LiN3•H2O.

Фтори́д бери́ллия — бинарное неорганическое химическое соединение бериллия и фтора, химической формулой BeF2, бериллиевая соль фтористоводородной кислоты. Токсичен и канцерогенен, как и все соединения бериллия. Попадание пыли, содержащей галогениды, оксид и другие соединения бериллия, в лёгкие вызывает бериллиоз.

Окси́д-сульфа́т тита́на — неорганическое соединение, оксосоль металла титана и серной кислоты с формулой  бесцветные с желтоватым оттенком кристаллы, растворимые в воде, образует кристаллогидраты.
бесцветные с желтоватым оттенком кристаллы, растворимые в воде, образует кристаллогидраты.

Окси́д га́фния(IV) — бинарное неорганическое соединение металла гафния и кислорода с формулой  бесцветные кристаллы или белый порошок, нерастворим в воде, из растворов солей выделяется в виде кристаллогидрата.
бесцветные кристаллы или белый порошок, нерастворим в воде, из растворов солей выделяется в виде кристаллогидрата.

Сульфат ртути(II) — неорганическое соединение, соль металла ртути и серной кислоты с формулой HgSO4, бесцветные кристаллы, гидролизуется в воде.
Ази́д ба́рия — неорганическое соединение, соль металла бария и азотистоводородной кислоты, бесцветное кристаллическое вещество, растворяется в воде, при выпаривании раствора образует кристаллогидрат  .
.

Формиа́т ли́тия — неорганическое соединение, соль лития и муравьиной кислоты с формулой LiHCO2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Гидросульфа́т ли́тия — неорганическое соединение, кислая соль лития и серной кислоты с формулой LiHSO4, бесцветные кристаллы, растворяется в воде.
Гипофосфит лития — неорганическое соединение, соль лития и фосфорноватистой кислоты кислоты с формулой LiPH2O2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Гидрокси́д плуто́ния(IV) — неорганическое соединение, гидроксид плутония с химической формулой  , не растворяется в воде, образует кристаллогидраты — тёмно-зелёный или оливково-зелёный аморфный осадок.
, не растворяется в воде, образует кристаллогидраты — тёмно-зелёный или оливково-зелёный аморфный осадок.









![{\displaystyle {\ce {Li2SO4 + 4C ->[800\ ^o{\ce {C}}] Li2S + 4CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/32a26404600572b64ef7ee8f8645fef6ec3b267b)





















