Сульфитредуктаза
| Сульфитредуктаза | |
|---|---|
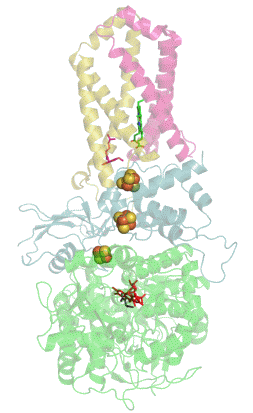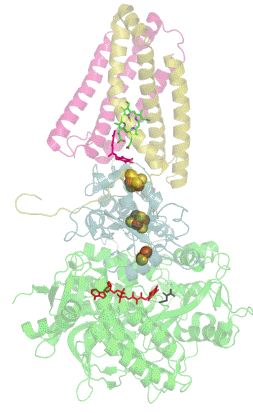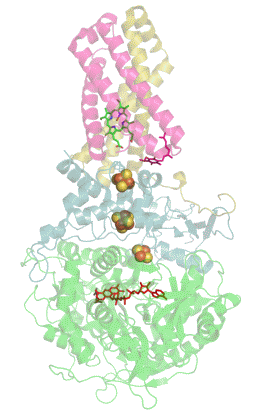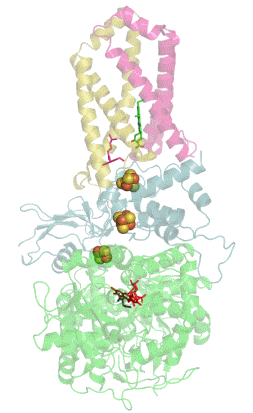
![Структура сульфитредуктазы из E. coli[1].](https://upload.wikimedia.org/wikipedia/commons/thumb/6/60/1aop_SulfiteReductase.jpg/230px-1aop_SulfiteReductase.jpg) Структура сульфитредуктазы из E. coli[1]. | |
| Идентификаторы | |
| Шифр КФ | 1.8.99.1 |
| Номер CAS | 37256-51-2 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 37256-51-2 |
Сульфитредуктаза (шифр КФ 1.8.99.1) — важный фермент, участвующий в метаболизме серы[2]. Он катализирует восстановление сульфита до сероводорода и воды[2][3]. Электроны для реакции поставляются от таких восстановительных эквивалентов как НАДФН, связанных флавиновых групп, или ферредоксина (у растений)[4]. По свойствам и строению фермент похож на нитритредуктазу.
- SO32− (сульфит) + донор электронов H2S (сероводород) + окисленный донор + 3 H2O
Сульфитредуктаза принадлежит к семейству оксидоредуктаз, и была обнаружена у архей, бактерий, грибов, и растений[5]. В зависимости от их функций, каталитических свойств и спектральных характеристик их подразделяют на ассимиляционные и диссимиляционные сульфитредуктазы. Систематическое имя для этого класса ферментов сероводород: акцептор оксидоредуктаза. Другие обычно используемые имена: ассимилирующая сульфитредуктаза, и сероводород: (акцептор) оксидоредуктаза.
Фермент участвует в метаболизме селеноцистеина и ассимиляции серы. Он содержит два ковалентно связанных кофакторов — железосерный кластер [4Fe-4S] и сирогем — который переносит электроны на субстрат. Состоит из двух или четырёх субъединиц по 64-71 кДа. Каждая субъединица имеет сирогем и 4Fe-4S-кластер. Km SO32- = 10 μМ [6].
Примечания
- ↑ PDB 1AOP; Crane B.R., Siegel L.M., Getzoff E.D. Sulfite reductase structure at 1.6 Å: evolution and catalysis for reduction of inorganic anions (англ.) // Science : journal. — 1995. — October (vol. 270, no. 5233). — P. 59—67. — doi:10.1126/science.270.5233.59. — PMID 7569952.
- ↑ 1 2 Parey K., Warkentin E., Kroneck P.M., Ermler U. Reaction cycle of the dissimilatory sulfite reductase from Archaeoglobus fulgidus (англ.) // Biochemistry : journal. — 2010. — Vol. 49, no. 41. — P. 8912—8921. — doi:10.1021/bi100781f. — PMID 20822098.
- ↑ Pinto R., Harrison J.S., Hsu T., Jacobs W.R., Leyh T.S. Sulfite Reduction in Mycobacteria (англ.) // J. Bacteriol.[англ.] : journal. — 2007. — September (vol. 189, no. 18). — P. 6714—6722. — doi:10.1128/JB.00487-07. — PMID 17644602. — PMC 2045171.
- ↑ Siegel L.M., Murphy M.J., Kamin H. Reduced nicotinamide adenine dinucleotide phosphate-sulfite reductase of enterobacteria. I. The Escherichia coli hemoflavoprotein: molecular parameters and prosthetic groups (англ.) // J. Biol. Chem. : journal. — 1973. — January (vol. 248, no. 1). — P. 251—264. — PMID 4144254.
- ↑ Schnell R., Sandalova T., Hellman U., Lindqvist Y., Schneider G. Siroheme- and [Fe4-S4]-dependent NirA from Mycobacterium tuberculosis is a sulfite reductase with a covalent Cys-Tyr bond in the active site (англ.) // J. Biol. Chem. : journal. — 2005. — July (vol. 280, no. 29). — P. 27319—27328. — doi:10.1074/jbc.M502560200. — PMID 15917234.
- ↑ Crane B.R., Getzoff E.D. The relationship between structure and function for the sulfite reductases (англ.) // Curr. Opin. Struct. Biol. : journal. — 1996. — December (vol. 6, no. 6). — P. 744—756. — doi:10.1016/S0959-440X(96)80003-0. — PMID 8994874.
Дальнейшее чтение
- Asada K. Purification and properties of a sulfite reductase from leaf tissue (англ.) // J. Biol. Chem. : journal. — 1967. — August (vol. 242, no. 16). — P. 3646—3654. — PMID 6038492.
- Asada K., Tamura G., Bandurski R.S. Methyl viologen-linked sulfite reductase from spinach leaves (англ.) // J. Biol. Chem. : journal. — 1969. — September (vol. 244, no. 18). — P. 4904—4915. — PMID 5824566.
- Yoshimoto A., Nakamura T., Sato R. Isolation from Aspergillus nidulans, of a protein catalyzing the reduction of sulfite by reduced viologen dyes (англ.) // J. Biochem.[англ.] : journal. — 1967. — December (vol. 62, no. 6). — P. 756—766. — PMID 558953.