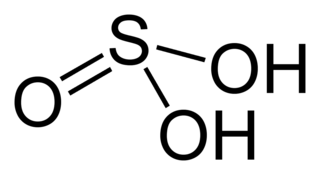
Сульфит натрия
| Сульфит натрия | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Хим. формула | Na2SO3 | ||
| Физические свойства | |||
| Молярная масса | 126,037 г/моль | ||
| Плотность | 2,633 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 500 °C[1] | ||
| • разложения | 600 °C[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) | ||
| Классификация | |||
| Рег. номер CAS | 7757-83-7 | ||
| PubChem | 24437, 20625341 и 516934 | ||
| Рег. номер EINECS | 231-821-4 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E221 | ||
| RTECS | WE2150000 | ||
| ChEBI | 86477 | ||
| ChemSpider | 22845 | ||
| Безопасность | |||
| Токсичность | умеренная | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Сульфи́т на́трия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с химической формулой Na2SO3. Белый порошок или кристаллы с солёным вкусом. Важная пищевая добавка, используемая в пищевой промышленности как консервант, антиоксидант, отбеливатель и стабилизатор цвета продуктов питания. Входит в свод международных пищевых стандартов Кодекс Алиментариус под названием E221. Помимо пищевого применения, используется также в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.
История
В фотографии впервые было использовано в 1882 году Х. Б. Беркли для пирогаллоловых проявителей с целью уменьшить пятна, возникающие на фотоматериале в процессе обработки. С 1882 года многие составы включали в себя сульфитные ионы, как правило с целями защиты проявителя от окисления, но в целом роль этих ионов была малопонятна и только спустя годы исследований удалось выявить значительный ряд функций этого соединения в составе проявляющих растворов[2].
Физические свойства
 |
Соединение имеет вид бесцветных кристаллов гексагональной сингонии с параметрами: a=0,5459 нм, с=0,6160 нм, z=2, пространственная группа C3, также выпускается в виде мелкого белого порошка, иногда имеющего розоватый оттенок. Обладает холодящим солёным вкусом и слабым запахом диоксида серы. Молярная масса 126,04 г/моль, плотность 2,633 г/см3. Растворим в воде, при этом с ростом температуры растворимость сначала растёт, достигая максимума растворимости при 33,4 °C, затем начинает снижаться; растворимость составляет (в 100 г воды): 14,29 г (0 °C), 26,10 г (20 °C), 36,99 г (40 °C), 29,20 г (80 °C). Также растворим в этиловом спирте, нерастворим в жирах и маслах[3][4].
Образует гептагидрат Na2SO3·7H2O при кристаллизации из водных растворов ниже 33,4 °C. Гептагидрат сульфита натрия имеет молярную массу 252,14 г/моль и плотность 1,539 г/см3[3][4].
Химические свойства
Сульфит натрия устойчив на воздухе при комнатной температуре, но при сильном нагревании разлагается с образованием плава сульфата натрия и сульфида натрия[5][3]:
- ,
при этом при температуре выше 800 °C разложение идёт до образования оксида натрия и диоксида серы[3].
Гептагидрат сульфита натрия во влажном воздухе легко окисляется до сульфата натрия, для замедления окисления используют ингибиторы — гидрохинон, пирогаллол, 1,4-фенилендиамин. В сухом воздухе гептагидрат не окисляется, но частично теряет кристаллизационную воду, полностью обезвоживаясь при температуре 150—160 °C[3].
Водные растворы сульфита натрия имеют щелочную реакцию, при их подкислении происходит выделение диоксида серы[6].
Сульфит натрия является сильным восстановителем. В водных растворах находится в частично гидролизованном состоянии, легко окисляется кислородом воздуха, перманганатом калия, бихроматом калия, бромом, иодом и другими окислителями до сульфата натрия. Растворы сульфита натрия поглощают диоксид серы, образуя гидросульфит натрия, а при кипячении присоединяют серу с образованием тиосульфата натрия. В кислых растворах хлорида титана (III), двуххлористого олова и хлорида железа (II) восстанавливается до дитионита натрия или до сульфида натрия[3].
Фотографические свойства
Многочисленные исследования свойств сульфита натрия в составе проявляющих растворов показали, что действие этого соединения не ограничивается узкой областью снижения количества пятен на эмульсии, образующихся в процессе обработки в некоторых окрашивающих проявителях, для чего это соединение было предложено изначально. Практически сразу сульфит натрия стал использоваться в своей роли основного универсального сохраняющего вещества, что было вызвано его многоаспектным действием на фотографические составы при всех этапах проявления и хранения растворов[7].
Антиоксидант
Основная роль сульфита натрия в составе фотографических проявляющих растворов заключается в защите органических проявляющих веществ от окисления кислородом воздуха. При высоком значении pH раствора проявляющее вещество в отсутствие сульфита быстро окисляется, становясь фотографически неактивным. Например, гидрохинон сначала превращается в хинон, вследствие чего раствор приобретает жёлтую окраску, а затем в фотографически неактивный оксихинон, окрашивающий раствор в тёмно-коричневый цвет. Небольшое количество сульфита натрия резко замедляет этот процесс за счёт того, что вместо гидрохинона с кислородом в первую очередь будет реагировать сам сульфит с образованием сульфата натрия. Присутствие же органического проявляющего вещества, в свою очередь, является ингибитором процесса окисления сульфита кислородом[9].
Точный механизм ингибирования окисления органических проявляющих веществ неизвестен, но предполагается, что он обусловлен связыванием сульфитом натрия окрашенных окисленных форм проявляющих веществ, которые в несвязанном состоянии катализируют дальнейшее окисление своей неокисленной формы[9].
Окисление гидрохинона кислородом воздуха в растворах, содержащих сульфит натрия, будет происходить уже не с образованием хинона и оксихинона, а с образованием бесцветного добезилата натрия, который также является проявляющим веществом[9]:
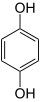 + O2 + 2 Na2SO3
+ O2 + 2 Na2SO3  + Na2SO4 + NaOH
+ Na2SO4 + NaOH
Разрыв цепи полимеризации
При проявлении гидрохиноном и его производными в растворе образуются семихиноны — высокоактивные и нестабильные соединения. Они имеют тенденцию к полимеризации в гуминовые кислоты, цепи которых в типичных условиях для фотографического проявления образуются из порядка 10 молекул окисленных остатков гидрохинона и имеют тёмную окраску. Так как на стадии образования семихинона сульфит реагирует с ним, то полимеризации, как правило, не происходит, а следовательно, не будет и каталитического воздействия данных полимерных соединений на неокисленную форму проявляющего вещества. Тем не менее, для пирогаллола сульфит не способен взаимодействовать с нерастворимыми окрашенными продуктами окисления, аналогично и для слабоокрашенных продуктов окисления фенидона и L-аскорбиновой кислоты[7].
Обесцвечивающий агент
Сульфит натрия в описанном выше процессе связывания окрашенных форм образует бесцветные соединения, вместо сильноокрашенных, тем самым снижая нежелательные пятна и окраску результирующего изображения[7].
Поддержание активности проявления
Окисленные остатки проявляющего вещества в растворе, хотя и непосредственно не реагируют с галогенидом серебра в эмульсии, но изменяют pH среды и другие её показатели, что может вести либо к нарастанию скорости проявления, либо к её спаду. Лишь немногие проявляющие вещества не дают подобного эффекта. Рост активности наблюдается в проработавших растворах проявляющих веществ, имеющих активные гидроксогруппы, например у глицина-фото. Если же проявляющее вещество имеет только аминогруппы, то скорость проявления будет падать. Превращение окисленных форм в сульфонаты при реакции с сульфитом стабилизирует и поддерживает активность, тем самым позволяя избегнуть нежелательного пере- или недопроявления[7].
Получение
Сульфит натрия получают:
- взаимодействием растворов карбоната натрия с диоксидом серы[5]:
- Процесс насыщения раствора диоксидом проводят под тягой при 40 °C, после этого кристаллизуют раствор, защищая его от действия кислорода, выход реакции 80%[5].
- нейтрализацией раствора NaHSO3 раствором гидроксида натрия при 38—40 °C с последующим охлаждением и кристаллизацией гептагидрата.
- реакцией гидроксида натрия и диоксида серы:
Безводную соль:
- выделяют кристаллизацией при 100—105 °C. Если процесс проводится из технического продукта, то для осаждения примесей кальция, магния и других металлов в раствор предварительно добавляют небольшое количество гидроксида натрия и отфильтровывают выпавший осадок. Продукт стехиометрического состава при этом способе можно получить только в атмосфере водорода[5];
- получают обезвоживанием гептагидрата;
- получают реакцией NaHSO3 с Са(ОН)2:
Применение
В пищевой промышленности используется как консервант. Кодекс Алиментариус допускает индивидуальное использование или вместе с другими сульфитами, например, для морских полупродуктов до 300 мг/кг и до 30 мг/кг готовых продуктов, в замороженных картофельных изделиях до 50 мг/кг, а также в концентрате ананасового сока до 500 мг/кг. В РФ разрешён в различных готовых продуктах с концентрацией до 500 мг / кг (для сушёных фруктов и орехов) и в некоторых полупродуктах до 3 г/кг (для полупродуктов из вишни), в частности, в колбасных издениях до 450 мг/кг, в винах до 300 мг/кг. При содержании менее 10 мг/кг (в расчёте на диоксид серы) сульфит натрия допускается не указывать на этикетке[4].
Применяют для удаления следов хлора после отбеливания тканей, для удаления серы из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих хром[3].
В фотографии используют как основное сохраняющее вещество в проявителях, входит в состав фиксажей и других растворов[10][3].
В косметике применяется с допустимым содержанием 0,2% (свободного диоксида серы)[4].
Безопасность
Временно допустимая концентрация в воздухе составляет 0,1 мг/м3[3].
В качестве пищевой добавки допустимое суточное потребление составляет 0,7 мг/кг массы тела (в пересчёте на диоксид серы), установленное Объединённым экспертным комитетом ФАО/ВОЗ по пищевым добавкам (JECFA) в 1998 году[11] и впоследствии утверждённое Европейским агентством по безопасности продуктов питания (EFSA) в 2016 году[12]. Уровень, не вызывающий видимых отрицательных эффектов (УНВОЭ) для животных составляет 70 мг/кг массы тела[12].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в США считает сульфит натрия как «общепризнанную безопасную» (GRAS) пищевую добавку, за исключением его использования в продуктах, признанных источником витамина B1 (тиамина), поскольку сульфит натрия (наряду с добавками E220-E228, выделяющими диоксид серы) разлагает этот витамин и его использование в перечне богатых витамином B1 продуктов, а также во фруктах и овощах запрещено[13].
Примечания
- ↑ 1 2 SODIUM SULFITE
- ↑ Haist, 1979, с. 220.
- ↑ 1 2 3 4 5 6 7 8 9 Белоусова, 1992.
- ↑ 1 2 3 4 5 Сарафанова, 2004, с. 585—587.
- ↑ 1 2 3 4 Карякин, 1974, с. 271.
- ↑ Стасиневич, 1964.
- ↑ 1 2 3 4 5 Haist, 1979, с. 220—229.
- ↑ Редько, 2006, с. 857.
- ↑ 1 2 3 Редько, 2006, с. 856.
- ↑ Гурлев, 1988, с. 296.
- ↑ World Health Organization. SODIUM SULFITE // Joint FAO/WHO Expert Committee on Food Additives. Архивировано 15 октября 2022 года.
- ↑ 1 2 EFSA Panel on Food additives and Nutrient Sources added to Food (ANS). Scientific Opinion on the re‐evaluation of sulfur dioxide (E 220), sodium sulfite (E 221), sodium bisulfite (E 222), sodium metabisulfite (E 223), potassium metabisulfite (E 224), calcium sulfite (E 226), calcium bisulfite (E 227) and potassium bisulfite (E 228) as food additives // EFSA Journal. — 2016-04. — Т. 14, вып. 4. — doi:10.2903/j.efsa.2016.4438.
- ↑ CFR - Code of Federal Regulations Title 21 (англ.). FDA. Дата обращения: 16 октября 2022. Архивировано 17 октября 2022 года.
Литература
- Белоусова А. П. Натрия сульфит : статья // Химическая энциклопедия / Гл. ред. Кнунянц И. Л. — М. : Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 186. — 639 с. — ISBN 5-85270-039-8.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — ISBN 5-335-00125-4.
- Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М.: Химия, 1974. — 408 с.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО "Профессионал", 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
- Сарафанова Л. А. Пищевые добавки: Энциклопедия. — 2-е изд., испр. и доп.. — СПб.: ГИОРД, 2004. — 808 с. — ISBN 5-901065-79-04.
- Стасиневич Д. С. Натрия сульфит : статья // Краткая химическая энциклопедия / Редкол.: Кнунянц И. Л. (отв. ред.) и др.. — М. : Советская энциклопедия, 1964. — Т. 3: Мальтаза—Пиролиз. — С. 384.
- Haist G. M. Modern Photographic Processing. — New York, Chichester, Brisbane, Toronto: John Whiley and sons, 1979. — Т. 1. — (Photographic science and technology and graphic arts). — ISBN 0-471-02228-4.
Ссылки
- ГОСТ 5644-75 Сульфит натрия безводный. Технические условия (с Изменениями N 1, 2, 3, 4). Государственный комитет СССР по стандартам. Дата обращения: 15 апреля 2019.
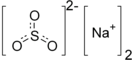



![{\displaystyle {\ce {->[H_{2}O]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ca95c32e7ebd36b1e7ce051d5dcd6643e962bf3)