Суперсемейство белков
Суперсемейство белков — это наиболее крупная единица группировки белков, для которых может быть предположено наличие общего эволюционного предка (см. гомология (биология)). Обычно суперсемейство объединяется по принципу сходства вторичных и третичных структур («структурного сходства») белков, входящих в него[1] и по принципу сходства механизма действия белков («механистическое сходство» или «функциональное сходство»), несмотря на то, что сходства аминокислотных последовательностей в пределах суперсемейства может не наблюдаться и чаще всего не наблюдается[2]. Суперсемейства обычно содержат несколько семейств белков, которые проявляют сходство аминокислотных последовательностей внутри семейств, но не между семействами. Термин «клан белков» часто применяется по отношению к суперсемействам протеаз, на основании классификации MEROPS[2].
Идентификация суперсемейств


Гомология последовательностей
Члены суперсемейства белков, входящие в разные семейства, обычно не проявляют сколько-нибудь значимой или легко обнаруживаемой гомологии аминокислотных последовательностей, имея тем не менее при этом сходные вторичную и третичную структуры и нередко обладая неким функциональным подобием. Часто их бывает почти невозможно или по крайней мере очень трудно выровнять по аминокислотным последовательностям, вследствие часто наблюдаемых вставок и делеций. Например, в суперсемействе PA протеаз ни один аминокислотный остаток не является консервативным в масштабах всего суперсемейства, включая даже те аминокислотные остатки, которые входят в состав каталитических триад этих белков.
И напротив, членов отдельных семейств, входящих в состав суперсемейства, определяют именно по принципу гомологичности аминокислотных последовательностей (первичных структур) белков, входящих в семейство. Например, в суперсемействе PA протеаз есть семейство C04 протеаз.
Структурная гомология
Вторичная и третичная структуры белков, непосредственно влияющие на их функциональность (например, способность рецептора распознавать лиганды — агонисты и антагонисты, или способность фермента катализировать определённые химические реакции) — гораздо более эволюционно консервативна, чем аминокислотная последовательность. Примером этого является суперсемейство PA протеаз. В нём очень немногие аминокислотные остатки белков проявляют значительную степень эволюционной консервативности, в то время как характерные элементы вторичной структуры, равно как и их пространственное упорядочение в третичных структурах, весьма высоко консервативно.
Программы структурного упорядочения и выравнивания, такие, как программа DALI, могут использовать трёхмерные вторичные и третичные структуры интересующих исследователя белков с имеющейся в них базой данных белковых структур с целью найти белки со сходным фолдингом. Сравнение трёхмерных вторичных и третичных структур белков помогает идентифицировать множество случаев эволюционно связанных (имеющих общего эволюционного предка) белков, сходство которых не было бы выявлено при простом анализе и сравнении их первичных структур (аминокислотных последовательностей).
Сходство по механизму и функциональное сходство
Каталитический механизм ферментов, являющихся членами суперсемейства, обычно более или менее консервативен в масштабах всего суперсемейства, однако их субстратная специфичность может весьма значительно различаться в масштабах суперсемейства. Как следствие, может значительно варьировать конечное функциональное назначение белков в организме, в зависимости от того, какова их субстратная специфичность. То есть внешнего функционального сходства может и не быть.
Также (хотя и не обязательно и не всегда) каталитический домен у ферментов, являющихся членами суперсемейства, проявляет тенденцию к высокой степени консервативности аминокислотной последовательности в пределах именно этого домена (и уж тем более — вторичной и третичной структуры каталитического домена). Однако даже если аминокислотная последовательность каталитического домена не сохраняется — может сохраняться сам каталитический механизм, и/или вторичная и третичная структуры каталитического домена.
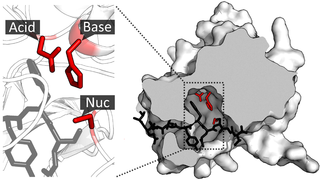
Примером вышеописанного сохранения каталитического механизма в масштабах суперсемейства является, опять-таки, суперсемейство PA протеаз. В нём имеются белки весьма разного конечного функционального назначения (то есть, внешнее функциональное сходство отсутствует) — среди них есть пищеварительный фермент химотрипсин, тромболитический фермент — активатор плазминогена, токсины бактерий и змей и вирусные протеазы, обеспечивающие сборку вирусных частиц. Как уже говорилось выше, в масштабах этого суперсемейства не является эволюционно консервативным ни один аминокислотный остаток, даже в каталитическом домене. И тем не менее все члены суперсемейства имеют значительное сходство специфических каталитических элементов их трёхмерных структур. Более того, хотя члены разных семейств суперсемейства PA протеаз используют разные нуклеофилы, все они производят ковалентный нуклеофильный каталитический протеолиз белков или пептидов по общему каталитическому механизму.
Эволюционное значение
Суперсемейства белков отражают ограниченность наших современных способностей идентифицировать общего предка[3]. Суперсемейства белков — это самое крупное эволюционно значимое объединение сходных белков и генов, которое возможно сделать на текущий момент, основываясь на прямых доказательствах сходства (в случае суперсемейств — в основном структурного, и отчасти по механизму). Поэтому обнаружение трёхмерно-структурного сходства функционально и аминокислотно различных белков у живых существ, отстоящих очень далеко на эволюционной лестнице, является одним из доказательств очень древних (возможно, наиболее древних среди вообще доступных изучению) эволюционных событий.
В некоторых белковых суперсемействах имеются белки, в том или ином виде присутствующие у всех исследованных живых существ (например калиевые каналы), во всех царствах (включая и животные, и растения, и грибы, и бактерий и других прокариот). Это может свидетельствовать, что общим предком белков этих суперсемейств были белки, присутствовавшие у универсального общего предка всех живых существ[4].
Члены суперсемейства могут обнаруживаться у разных видов животных, растений, одноклеточных существ (ортологичные белки). При этом наиболее эволюционно древними являются, очевидно, те члены суперсемейства, которые принадлежат существам, находящимся на самых нижних ступенях эволюционной лестницы. Общим предком для этих белков, очевидно, является белок некоего древнего вымершего существа, которое являлось общим предком для всех тех видов, у которых обнаруживаются белки-представители суперсемейства. Таким образом, изучение ортологичных белков в пределах суперсемейств белков может позволить точнее нарисовать дерево эволюции видов.
Помимо этого, в одном и том же организме животного, растения или одноклеточного существа одного и того же вида могут обнаруживаться несколько разных представителей некоего суперсемейства белков (в том числе выполняющие разные функции). Такие белки называют паралогичными. Эти паралогичные белки также могут происходить от одного общего белкового предка, который на каком-то этапе эволюции дуплицировался в геноме данного вида. Изучение паралогичных белков, их сходств и различий, помогает пролить свет на пути функциональной эволюции белков.
Примеры
- Суперсемейство PA протеаз — суперсемейство химотрипсин-подобных протеаз. Члены суперсемейства имеют в своём составе сходную структуру в виде двойной β-бочки и сходные механизмы протеолиза, однако степень гомологичности аминокислотных последовательностей менее 10 %. Суперсемейство содержит как цистеиновые, так и сериновые протеазы (то есть использует разные нуклеофилы). Тем не менее, члены семейства имеют сходный каталитический механизм и сходное трёхмерное пространственное строение каталитического домена.[2][5]
- Суперсемейство α/β гидролаз. Члены суперсемейства содержат сходную структуру в виде α/β-листа, содержащую 8 β-нитей, соединённых α-спиралями, при этом аминокислотные остатки каталитического домена у всех членов суперсемейства находятся на одном и том же месте в одном и том же порядке,[6] хотя среди членов суперсемейства имеются протеазы, липазы, пероксидазы, эстеразы, эпоксид-гидролазы и дегалогеназы.[7]
- Суперсемейство Ras-подобных белков. Члены суперсемейства имеют общий каталитический G-домен.
- Суперсемейство TIM-бочек. Члены суперсемейства имеют общую большую α8β8 бочкообразную структуру. Это одна из наиболее распространённых свёрток среди белков, и поэтому правомерность объединения их всех в одно семейство (монофильность этих белков) всё ещё оспаривается.[8][9]
- Суперсемейство щелочных фосфатаз. Члены суперсемейства имеют общую структуру, напоминающую αβα-бутерброд,[10] а кроме того, катализируют распространённые фосфатазные реакции по общему механизму.[11]
Ресурсы, посвященные суперсемействам белков
Несколько биологических баз данных документируют суперсемейства белков, в частности:
- Pfam
- PROSITE
- InterPro
- PASS2
- SUPERFAMILY
- SCOP и CATH
См. также
Примечания
- ↑ Holm, L; Rosenström, P. Dali server: conservation mapping in 3D. (англ.) // Nucleic Acids Research : journal. — 2010. — July (vol. 38, no. Web Server issue). — P. W545—9. — doi:10.1093/nar/gkq366. — PMID 20457744.
- ↑ 1 2 3 Rawlings, ND; Barrett, AJ; Bateman, A. MEROPS: the database of proteolytic enzymes, their substrates and inhibitors. (англ.) // Nucleic Acids Research : journal. — 2012. — January (vol. 40, no. Database issue). — P. D343—50. — doi:10.1093/nar/gkr987. — PMID 22086950. — PMC 3245014.
- ↑ Shakhnovich, BE; Deeds, E; Delisi, C; Shakhnovich, E. Protein structure and evolutionary history determine sequence space topology. (англ.) // Genome Research : journal. — 2005. — March (vol. 15, no. 3). — P. 385—392. — doi:10.1101/gr.3133605. — PMID 15741509.
- ↑ Ranea, JA; Sillero, A; Thornton, JM; Orengo, C. A. Protein superfamily evolution and the last universal common ancestor (LUCA). (англ.) // Journal of molecular evolution[англ.] : journal. — 2006. — October (vol. 63, no. 4). — P. 513—525. — doi:10.1007/s00239-005-0289-7. — PMID 17021929.
- ↑ Bazan, JF; Fletterick, R. J. Viral cysteine proteases are homologous to the trypsin-like family of serine proteases: structural and functional implications. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1988. — November (vol. 85, no. 21). — P. 7872—7876. — doi:10.1073/pnas.85.21.7872. — PMID 3186696. — PMC 282299.
- ↑ Carr P. D., Ollis D. L. Alpha/beta hydrolase fold: an update (неопр.) // Protein Pept. Lett.. — 2009. — Т. 16, № 10. — С. 1137—1148. — PMID 19508187.
- ↑ Nardini M., Dijkstra B. W. Alpha/beta hydrolase fold enzymes: the family keeps growing (англ.) // Curr. Opin. Struct. Biol. : journal. — 1999. — December (vol. 9, no. 6). — P. 732—737. — doi:10.1016/S0959-440X(99)00037-8. — PMID 10607665.
- ↑ Nagano, N; Orengo, CA; Thornton, J. M. One fold with many functions: the evolutionary relationships between TIM barrel families based on their sequences, structures and functions. (англ.) // Journal of Molecular Biology[англ.] : journal. — 2002. — 30 August (vol. 321, no. 5). — P. 741—765. — doi:10.1016/s0022-2836(02)00649-6. — PMID 12206759.
- ↑ Farber, G. An α/β-barrel full of evolutionary trouble (неопр.) // Current Opinion in Structural Biology. — 1993. — Т. 3, № 3. — С. 409—412. — doi:10.1016/S0959-440X(05)80114-9. Архивировано 24 сентября 2015 года.
- ↑ SCOP. Дата обращения: 28 мая 2014. Архивировано из оригинала 29 июля 2014 года.
- ↑ Mohamed, MF; Hollfelder, F. Efficient, crosswise catalytic promiscuity among enzymes that catalyze phosphoryl transfer. (англ.) // Biochimica et Biophysica Acta[англ.] : journal. — 2013. — January (vol. 1834, no. 1). — P. 417—424. — doi:10.1016/j.bbapap.2012.07.015. — PMID 22885024.