Сфингомиелиназа
| Сфингомиелинфосфодиэстераза | |
|---|---|
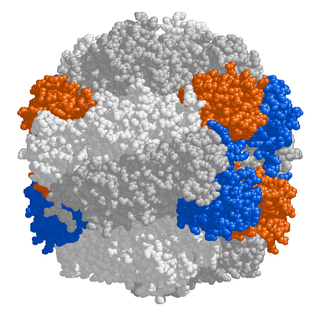
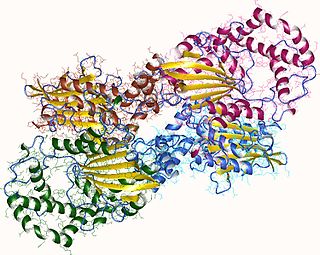
![Кристаллическая структура сфингомиелиназы из Bacillus cereus [1]](https://upload.wikimedia.org/wikipedia/commons/thumb/f/ff/Smasegeometry2.gif/274px-Smasegeometry2.gif) Кристаллическая структура сфингомиелиназы из Bacillus cereus [1] | |
| Обозначения | |
| Символы | SMPD1 |
| CAS | 9031-54-3 |
| Entrez Gene | 6609 |
| HGNC | 11120 |
| OMIM | 607608 |
| RefSeq | NM_000543 |
| UniProt | P17405 |
| Другие данные | |
| Шифр КФ | 3.1.4.12 |
| Локус | 11-я хр. , 11p15.4-15.1 |
Сфингомиелинфосфодиэстераза (КФ 3.1.4.12, сфингомиелиназа, англ. sphingomyelin phosphodiesterase, sphingomyelinase) — лизосомальный фермент, расщепляющий мембранный липид сфингомиелин на фосфатидилхолин и церамид. Недостаточность фермента приводит к значительному накоплению липидов в лизосомах, что вызывает заболевания, известные как болезнь Ниманна-Пика[2]. Существует 5 форм фермента: кислая сфингомиелиназа (SMPD1), нейтральные (SMPD2, SMPD3) и кислая сфингомиелиназо-подобная (SMPDL3A, SMPDL3B).
Семейство сфингомиелиназ
Выявлено пять типов сфингомиелиназ. Они классифицируются в соответствии с их катионной зависимостью и оптимумом действия pH и включают в себя:
- Лизосомальная кислая
- Секретируемая цинк-зависимая кислая
- Магний-зависимая нейтральная
- Магний-независимый нейтральная
- Щелочная
Из них лизосомальная кислая и магний-зависимая нейтральная считаются основными кандидатами на продукцию церамида в клеточной реакции на стресс[3].
Нейтральная сфингомиелиназа
Активность нейтральной сфингомиелиназы была впервые описана в фибробластах пациентов с болезнью Ниманна-Пика — лизосомальной болезнью накопления, характеризующейся дефицитом кислой сфингомиелиназы[4]. Последующее исследование показало, что этот фермент был продуктом отдельного гена, имел оптимальный pH 7,4, его активность зависела от ионов Mg2+ , а его повышенная концентрация была отмечена в головном мозге.[5]. Однако более недавнее исследование головного мозга крупного рогатого скота подтвердило существование множества изоформ нейтральной сфингомиелиназы с различными биохимическими и хроматографическими свойствами[6].
Главный прорыв произошел в середине 1980-х годов с клонированием первых сфингомиелиназ из Bacillus cereus и Staphylococcus aureus[7][8]. Использование последовательностей этих бактериальных сфингомиелиназ в поисках гомологии в конечном итоге привело к идентификации дрожжевых нейтральных сфингомиелиназ ISC1 в почкующихся дрожжах Saccharomyces cerevisiae[9] и ферментов нейтральных сфингомиелиназ млекопитающих, nSMase1 и nSMase2[10][11][12]. Идентичность между сфингомиелиназами млекопитающих, дрожжей и бактерий очень низкая — примерно 20 % между nSMase2 и SMase B. cereus. Однако выравнивание последовательностей (см. Рисунок) указывает на ряд консервативных остатков во всем семействе, особенно в каталитической области ферментов[13]. Это привело к предположению об общем каталитическом механизме для семейства нейтральных сфингомиелиназ.
Третий белок нейтральной сфингомиелиназы — nSMase3 — был клонирован и охарактеризован в 2006 году[14]. nSMase3 имеет небольшое сходство последовательностей с nSMase1 или nSMase2. Однако, по-видимому, существует высокая степень эволюционной консервативности от низших организмов к высшим, что позволяет предположить, что они могут включать уникальную и отличную нейтральную сфингомиелиназу. Высокая экспрессия nSMase3 в сердце и скелетных мышцах также предполагает потенциальную роль в функционировании сердца[14].
Активный сайт
Изучение построения кристаллической структуры нейтральной сфингомиелиназы из Listeria ivanovii и Bacillus cereus позволило более полно понять их ферментативный сайт. Активный сайт сфингомиелиназы B. Cereus содержит остатки Asn−16, Glu −53, Asp−195, Asn-197, и его −296. Известно, что из них остатки Glu-53, Asp-195 и His-296 важны для активности. Относительная каталитическая активность сфингомиелиназы, когда ионы металлов связаны с активным центром, была изучена для ионов двухвалентных металлов Co2+, Mn2+, Mg2+, Ca2+ и Sr2+. Из этих пяти ионов металлов Co2+, Mn2+ и Mg2+, при наличии связи с активным центром, приводят к высокой каталитической активности сфингомиелиназы. Ca2+ и Sr2+, связанные с активным центром, проявляют гораздо более низкую каталитическую активность сфингомиелиназы. Когда один ион Mg2+ или два иона Co2+ связываются с активным сайтом, двойные гекса-скоординированые результаты геометрии с двумя октаэдрическими би-пирамидами для Co2+ и один октаэдрической би-пирамиды для Mg2+. Когда один ион Ca2+ связывается с активным центром, в результате получается гепта-скоординированная геометрия. Следовательно, предполагается, что различие в каталитической активности для ионов металлов связано с геометрическими различиями. Что касается Co2+ и Mg2+, сфингомиелиназа имеет лучшую реакционную способность, при связывании двух ионов Co2+; когда эти ионы Co2+ связаны, каждый из Glu-53 и His-296 связывает один двухвалентный катион металла. Эти катионы окружены мостиковыми молекулами воды и действуют как кислоты Льюиса[15].
Механизм

Построение кристаллической структуры нейтральной сфингомиелиназы из Listeria ivanovii и Bacillus cereus также пролило свет на их каталитические механизмы. Активный сайт сфингомиелиназы содержит остатки Glu и His, каждый из которых связан с одним или двумя катионами двухвалентного металла, обычно Co2+ , Mg2+ или Ca2+ для оптимальной работы. Эти два катиона участвуют в катализе, привлекая SM к активному центру сфингомиелиназы. Двухвалентный катион, связанный с остатком Glu, взаимодействует с амидокислородом и кислородом сложного эфира между C1 и фосфатной SM группой; Остаток Asn и катион двухвалентного металла, связанный с остатком His, связываются с атомами кислорода фосфатной группы SM. Это стабилизирует отрицательный заряд фосфатной группы. Катион металла, связанный с остатком His и боковыми цепями Asp и Asn, снижает значение pKa одной из соединённых молекул воды, таким образом активируя молекулу воды. Затем эта молекула воды действует как нуклеофил и атакует фосфатную группу SM, создавая пятивалентный атом фосфора, отрицательный заряд которого стабилизируется катионами двухвалентных металлов. Затем фосфат преобразует свою тетраэдрическую конформацию с образованием церамида и фосфохолина[15].
Кислая сфингомиелиназа
Кислая сфингомиелиназа — один из ферментов, входящих в состав семейства сфингомиелиназ, ответственных за катализ деградации сфингомиелина до церамида и фосфатидилхолина. Они подразделяются на щелочную, нейтральную и кислую сфингомиелиназу в зависимости от pH, при котором их ферментативная активность оптимальна. На ферментативную активность кислых сфингомиелиназ могут влиять липиды, катионы, pH, окислительно-восстановительный потенциал, а также другие белки окружающей среды. В частности, было показано, что они обладают повышенной ферментативной активностью в среде, обогащенной лизобисфосфатидной кислотой (LBPA) или фосфатидилинозитолом (PI), и ингибируют активность при наличии фосфорилированных производных PI.
Сфингомиелинфосфодиэстераза 1 [SMPD1] — это ген, который кодирует два фермента кислой сфингомиелиназы, различных в пулах сфингомиелина, которые они гидролизуют. Лизосомальная сфингомиелиназа (L-SMase) обнаруживается в лизосомном компартменте, а секреторная сфингомиелиназа (S-SMase) обнаруживается внеклеточно.
Примечания
- ↑ PDB 2ddt; Ago H, Oda M, Takahashi M, Tsuge H, Ochi S, Katunuma N, Miyano M, Sakurai J (June 2006). "Structural basis of the sphingomyelin phosphodiesterase activity in neutral sphingomyelinase from Bacillus cereus". J. Biol. Chem. 281 (23): 16157—67. doi:10.1074/jbc.M601089200. PMID 16595670.
- ↑ P. B. Schneider, E. P. Kennedy. Sphingomyelinase in normal human spleens and in spleens from subjects with Niemann-Pick disease // Journal of Lipid Research. — 1967-05. — Т. 8, вып. 3. — С. 202–209. — ISSN 0022-2275. Архивировано 14 августа 2021 года.
- ↑ Сфингомиелин фосфодиэстераза. www.hmong.press. Дата обращения: 17 февраля 2022. Архивировано 17 февраля 2022 года.
- ↑ P. B. Schneider, E. P. Kennedy. Sphingomyelinase in normal human spleens and in spleens from subjects with Niemann-Pick disease // Journal of Lipid Research. — 1967-05. — Т. 8, вып. 3. — С. 202–209. — ISSN 0022-2275. Архивировано 17 февраля 2022 года.
- ↑ B. G. Rao, M. W. Spence. Sphingomyelinase activity at pH 7.4 in human brain and a comparison to activity at pH 5.0 // Journal of Lipid Research. — 1976-09. — Т. 17, вып. 5. — С. 506–515. — ISSN 0022-2275. Архивировано 17 февраля 2022 года.
- ↑ S. Y. Jung, J. H. Suh, H. J. Park, K. M. Jung, M. Y. Kim. Identification of multiple forms of membrane-associated neutral sphingomyelinase in bovine brain // Journal of Neurochemistry. — 2000-09. — Т. 75, вып. 3. — С. 1004–1014. — ISSN 0022-3042. — doi:10.1046/j.1471-4159.2000.0751004.x. Архивировано 17 февраля 2022 года.
- ↑ D. C. Coleman, J. P. Arbuthnott, H. M. Pomeroy, T. H. Birkbeck. Cloning and expression in Escherichia coli and Staphylococcus aureus of the beta-lysin determinant from Staphylococcus aureus: evidence that bacteriophage conversion of beta-lysin activity is caused by insertional inactivation of the beta-lysin determinant // Microbial Pathogenesis. — 1986-12. — Т. 1, вып. 6. — С. 549–564. — ISSN 0882-4010. — doi:10.1016/0882-4010(86)90040-9. Архивировано 17 февраля 2022 года.
- ↑ A. Yamada, N. Tsukagoshi, S. Udaka, T. Sasaki, S. Makino. Nucleotide sequence and expression in Escherichia coli of the gene coding for sphingomyelinase of Bacillus cereus // European Journal of Biochemistry. — 1988-08-01. — Т. 175, вып. 2. — С. 213–220. — ISSN 0014-2956. — doi:10.1111/j.1432-1033.1988.tb14186.x. Архивировано 17 февраля 2022 года.
- ↑ H. Sawai, Y. Okamoto, C. Luberto, C. Mao, A. Bielawska. Identification of ISC1 (YER019w) as inositol phosphosphingolipid phospholipase C in Saccharomyces cerevisiae // The Journal of Biological Chemistry. — 2000-12-15. — Т. 275, вып. 50. — С. 39793–39798. — ISSN 0021-9258. — doi:10.1074/jbc.M007721200. Архивировано 17 февраля 2022 года.
- ↑ Kaushlendra Tripathi. Role of Inositol Phosphosphingolipid Phospholipase C1, the Yeast Homolog of Neutral Sphingomyelinases in DNA Damage Response and Diseases // Journal of Lipids. — 2015. — Т. 2015. — С. 161392. — ISSN 2090-3030. — doi:10.1155/2015/161392. Архивировано 17 февраля 2022 года.
- ↑ S. Tomiuk, K. Hofmann, M. Nix, M. Zumbansen, W. Stoffel. Cloned mammalian neutral sphingomyelinase: functions in sphingolipid signaling? // Proceedings of the National Academy of Sciences of the United States of America. — 1998-03-31. — Т. 95, вып. 7. — С. 3638–3643. — ISSN 0027-8424. — doi:10.1073/pnas.95.7.3638. Архивировано 17 февраля 2022 года.
- ↑ S. Tomiuk, M. Zumbansen, W. Stoffel. Characterization and subcellular localization of murine and human magnesium-dependent neutral sphingomyelinase // The Journal of Biological Chemistry. — 2000-02-25. — Т. 275, вып. 8. — С. 5710–5717. — ISSN 0021-9258. — doi:10.1074/jbc.275.8.5710. Архивировано 17 февраля 2022 года.
- ↑ Christopher J. Clarke, Christopher F. Snook, Motohiro Tani, Nabil Matmati, Norma Marchesini. The extended family of neutral sphingomyelinases // Biochemistry. — 2006-09-26. — Т. 45, вып. 38. — С. 11247–11256. — ISSN 0006-2960. — doi:10.1021/bi061307z. Архивировано 17 февраля 2022 года.
- ↑ 1 2 Oleg Krut, Katja Wiegmann, Hamid Kashkar, Benjamin Yazdanpanah, Martin Krönke. Novel tumor necrosis factor-responsive mammalian neutral sphingomyelinase-3 is a C-tail-anchored protein // The Journal of Biological Chemistry. — 2006-05-12. — Т. 281, вып. 19. — С. 13784–13793. — ISSN 0021-9258. — doi:10.1074/jbc.M511306200. Архивировано 17 февраля 2022 года.
- ↑ 1 2 Hideo Ago, Masataka Oda, Masaya Takahashi, Hideaki Tsuge, Sadayuki Ochi. Structural basis of the sphingomyelin phosphodiesterase activity in neutral sphingomyelinase from Bacillus cereus // The Journal of Biological Chemistry. — 2006-06-09. — Т. 281, вып. 23. — С. 16157–16167. — ISSN 0021-9258. — doi:10.1074/jbc.M601089200. Архивировано 17 февраля 2022 года.