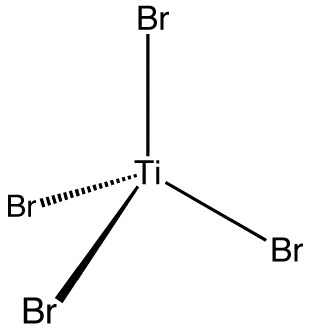
Тетрабромид кремния
| Тетрабромид кремния | |
|---|---|
| | |
| Общие | |
| Систематическое наименование | Тетрабромид кремния |
| Традиционные названия | Бромистый кремний; тетрабромсилан |
| Хим. формула | SiBr4 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 347,72 г/моль |
| Плотность | 2,814 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 5 °C |
| • кипения | 153 °C |
| Оптические свойства | |
| Показатель преломления | 1,579 |
| Структура | |
| Дипольный момент | 0 Кл·м[1] |
| Классификация | |
| Рег. номер CAS | 7789-66-4 |
| PubChem | 82247 |
| Рег. номер EINECS | 232-182-4 |
| SMILES | |
| InChI | |
| Номер ООН | 3264 |
| ChemSpider | 74225 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Тетраброми́д кре́мния — бинарное неорганическое соединение кремния и брома с формулой SiBr4, бесцветная жидкость, дымится на воздухе, гидролизуется водой.
Получение
- Пропускание паров брома над кремнием (в инертной атмосфере):
- Действие паров брома на диоксид кремния с углём:
Физические свойства
Тетрабромид кремния представляет собой бесцветную жидкость, которая сильно дымит на воздухе в результате гидролиза парами воды с образованием микроскопических частиц диоксида кремния.
В кристаллическом состоянии при −105°С происходит фазовый переход[2][3].
Химические свойства
- Легко гидролизуется водой:
Применение
Так как свойства SiBr4 сходны со свойствами тетрахлорида кремния, он используется при производстве сверхчистого кремния для изготовления полупроводниковых приборов в процессе пиролиза, его преимущества заключаются в большей лёгкости разложения. Но обычно все-таки используется тетрахлорид кремния, так как он более доступен на рынке в сверхчистом виде.
Также это соединение применяется для синтеза нитрида кремния Si3N4 в реакции пиролитического взаимодействия с аммиаком — весьма твёрдого соединения, используемого при производстве керамических изделий, металлорежущего инструмента и др.[4]
Другие галогенопроизводные кремния (SiX4)
| Параметр | SiF4 | SiCl4 | SiBr4 | SiI4 |
|---|---|---|---|---|
| Температура кипения, ˚C | -90,3 | 56,8 | 155,0 | 290,0 |
| Температура плавления, ˚C | -95,0 | -68,8 | 5,0 | 155,0 |
| Длина связи кремний-галоген, нм | 0,155 | 0,202 | 0,220 | 0,243 |
| Энергия связи кремний-галоген, кДж/моль | 582 | 391 | 310 | 234 |
Все эти соединения имеют тетраэдрическую структуру молекулы, но их свойства существенно зависят от природы галогена, это также относится к смешанным галогенидам кремния (например, дихлорид-дибромид кремния SiCl2Br2). Температуры плавления, кипения и длины связей кремний-галоген нарастают в ряду фтор — иод, напротив, энергия связи кремний-галоген падает[5][6].
Примечания
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Jianwei Tong, Constantin Hoch, Arndt Simon and Jürgen Köhler, Z. Kristallogr. NCS 226 (2011) 3-4
- ↑ Jianwei Tong, Constantin Hoch, Arndt Simon and Jürgen Köhler, Z. Kristallogr. NCS 226 (2011) 5-6
- ↑ Silicon Compounds, Inorganic. Simmler W.; Ullmann’s Encyclopedia of Industrial Chemistry; Wiley-VCH, 2002
- ↑ Silicon Compounds, Silicon Halides. Collins, W.: Kirk-Othmer Encyclopedia of Chemical Technology; John Wiley & Sons, Inc, 2001.
- ↑ Ebsworth, E. A. V. In Volatile Silicon Compounds; Taube, H.; Maddock, A. G.; Inorganic Chemistry; Pergamon Press Book: New York, NY, 1963; Vol. 4.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.