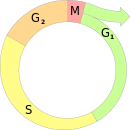
Точка рестрикции
То́чка рестри́кции (англ. restriction point, R point) — точка в G1-фазе клеточного цикла животных, в которой клетка принимает окончательное решение двигаться дальше по клеточному циклу. Точка рестрикции делит G1-фазу на два периода. В ходе первого из них (до R) для продвижения клетки по циклу ей необходима постоянная стимуляция митогенными сигналами (в том числе факторами роста), а также интенсивный синтез белка. После прохождения R подобная стимуляция уже не требуется[1][2].
История изучения
Первоначально в 1950-х Теминым было показано, что клетки курицы достигают определённой точки, при прохождении которой они становятся обязанными реплицировать свою ДНК и более не нуждаются во внеклеточных сигналах для движения по клеточному циклу[1]. Через 20 лет спустя, в 1973 году, Артур Парди[англ.] продемонстрировал, что в фазе G1 есть только одна точка рестрикции. До этого открытия фаза G1 определялась просто как временной промежуток между митозом и S-фазой. Долгое время не было известно никаких молекулярных и морфологических факторов, присущих только клеткам, находящимся в фазе G1. Парди использовал метод двойной блокировки (англ. double block), в ходе которой он переводил клетки из состояния блокировки клеточного цикла, вызванной удалением питательных веществ и сыворотки, в другое состояние блокировки и сравнивал эффективность каждой блокировки в предотвращении наступления S-фазы. Он показал, что во всех случаях обе блокировки были одинаково эффективны, следовательно, они обе влияли на одну и ту же точку в фазе G1, которую он назвал точкой рестрикции (R-точкой)[3].
В 1985 году Зеттерберг и Ларссон показали, что на всех стадиях клеточного цикла удаление сыворотки из среды приводит к подавлению синтеза белка. Только в постмитотических клетках (то есть клетках в ранней G1-фазе) удаление сыворотки переводило клетки в состояние покоя (фазу G0). Зеттерберг также показал, что практически все различия в длине клеточного цикла у разных клеток связаны с разной продолжительностью периода от точки рестрикции до S-фазы[4].
Внеклеточные сигналы
За исключением раннего эмбрионального развития, большая часть клеток организма находится в состоянии покоя, известном как фаза G0. Такие клетки не пролиферируют и, как правило, находятся в терминально дифференцированном состоянии. Некоторые специализированные клетки продолжают делиться и во взрослом организме. Каждая клетка из обеих групп в своё время приняла решение: уйти в состояние покоя или продолжить движение по клеточному циклу. Это решение принимается клеткой до S-фазы в фазе G1 в точке рестрикции и зависит от комбинации стимулирующих и подавляющих внешних сигналов, получаемых клеткой. До наступления точки рестрикции для движения клетки по фазе G1 необходимы внешние стимуляторы; после прохождения точки рестрикции, однако, внешние стимуляторы уже не нужны, и клетка необратимо движется по клеточному циклу в направлении репликации ДНК. Дальнейшее продвижение регулируется внутриклеточными механизмами. Если удалить внеклеточные стимуляторы до наступления точки рестрикции, клетка может уйти в фазу покоя[2][1]. В этом случае клетки «откатываются назад» по клеточному циклу, и им потребуется дополнительное время, чтобы после прохождения точки рестрикции вступить в S-фазу[1].
Механизм
Сигналы от внеклеточных факторов роста обрабатываются типичным образом. Фактор роста связывается с рецептором на поверхности клетки, и разнообразные каскады фосфорилирования приводят, в конечном счёте, к увеличению концентрации Ca2+ в цитозоле и фосфорилированию белков. Количество фосфопротеинов также регулируется фосфатазами. В конце концов происходит активация транскрипции нескольких генов-мишеней. До наступления точки рестрикции клетки нуждаются во внеклеточных факторах роста, кроме того, им необходимо достаточное для быстрого синтеза белка количество питательных веществ. Кроме того, требуется накопление циклина D[англ.][5].
Циклинзависимые киназы 4[англ.] и 6[англ.] (Cdk4 и Cdk6) связываются с циклином D, активируются Cdk-активирующими киназами и двигают клетку в направлении точки рестрикции. Циклин D, однако, имеет большую скорость кругооборота (время полураспада менее 25 минут). Именно из-за быстрого кругооборота циклина D клетки чрезвычайно чувствительны к митогенным сигналам, которые не только стимулируют образование циклина D в клетке, но и стабилизируют циклин D[5][6]. Таким образом, циклин D выступает в роли сенсора митогенных сигналов[6].
Активные комплексы циклина D и Cdk фосфорилируют белок ретинобластомы (pRb) в ядре. Нефосфорилированный pRb выступает ингибитором продвижения по фазе G1, предотвращая транскрипцию, опосредуемую E2F[англ.]. После фосфорилирования E2F стимулирует транскрипцию циклинов E[англ.] и A[англ.][5][6][7]. Начинает накапливаться активный комплекс циклин E-Cdk, который и завершает фосфорилирование pRb[8].
Рак
Рак можно рассматривать как нарушение нормальной работы точки рестрикции, потому что клетки ошибочно постоянно вступают в новый клеточный цикл, не уходя в фазу покоя G0[2]. Мутации в шагах клетки по клеточному циклу до точки рестрикции могут приводить к злокачественному перерождению. Наиболее часто такие мутации наблюдаются в генах, кодирующих Cdk и их ингибиторы (CKI). Слишком активные Cdk и слишком неактивные CKI снижают строгость прохождения точки рестрикции, позволяя клеткам избежать старения[7].
Точка рестрикции может быть важной для разработки новых противораковых препаратов. В нормальных физиологических условиях пролиферация всех клеток регулируется точкой рестрикции. Это обстоятельство можно использовать для защиты нераковых клеток от противораковой химиотерапии. Химиотерапевтические препараты обычно действуют на быстро пролиферирующие клетки. Используя препараты, блокирующие прохождение точки рестрикции, например, ингибиторы рецепторов факторов роста[англ.], можно предотвратить пролиферацию нормальных клеток и тем самым защитить их от пагубного действия химиотерапии[6].
Примечания
- ↑ 1 2 3 4 Zetterberg A., Larsson O., Wiman K. G. What is the restriction point? (англ.) // Current opinion in cell biology. — 1995. — Vol. 7, no. 6. — P. 835—842. — PMID 8608014.
- ↑ 1 2 3 Pardee A. B. G1 events and regulation of cell proliferation. (англ.) // Science (New York, N.Y.). — 1989. — Vol. 246, no. 4930. — P. 603—608. — PMID 2683075.
- ↑ Pardee A. B. A restriction point for control of normal animal cell proliferation. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1974. — Vol. 71, no. 4. — P. 1286—1290. — PMID 4524638.
- ↑ Zetterberg A., Larsson O. Kinetic analysis of regulatory events in G1 leading to proliferation or quiescence of Swiss 3T3 cells. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1985. — Vol. 82, no. 16. — P. 5365—5369. — PMID 3860868.
- ↑ 1 2 3 Sherr C. J., Roberts J. M. Inhibitors of mammalian G1 cyclin-dependent kinases. (англ.) // Genes & development. — 1995. — Vol. 9, no. 10. — P. 1149—1163. — PMID 7758941.
- ↑ 1 2 3 4 Blagosklonny, Mikhail V.; Pardee, Arthur B. The Restriction Point of the Cell Cycle // Cell Cycle Checkpoints and Cancer (неопр.) / Blagosklonny, Mikhail V.. — Austin: Landes Bioscience[англ.], 2001. — С. 52—?. — ISBN 978-1-58706-067-0.
- ↑ 1 2 Malumbres M., Barbacid M. To cycle or not to cycle: a critical decision in cancer. (англ.) // Nature reviews. Cancer. — 2001. — Vol. 1, no. 3. — P. 222—231. — doi:10.1038/35106065. — PMID 11902577.
- ↑ Holsberger D. R., Cooke P. S. Understanding the role of thyroid hormone in Sertoli cell development: a mechanistic hypothesis. (англ.) // Cell and tissue research. — 2005. — Vol. 322, no. 1. — P. 133—140. — doi:10.1007/s00441-005-1082-z. — PMID 15856309.