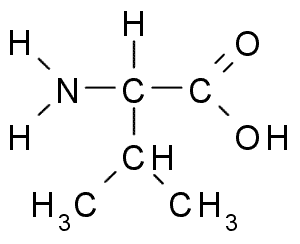
Вали́н — алифатическая α-аминокислота, одна из 20 протеиногенных аминокислот, входит в состав практически всех известных белков. Названо в честь растения валерианы.

Изолейцин (сокращённо Ile или I; 2-амино-3-метилпентановая кислота) — это алифатическая α-аминокислота, имеющая химическую формулу HO2CCH(NH2)CH(CH3)CH2CH3 и входящая в состав всех природных белков. Является незаменимой аминокислотой, что означает, что изолейцин не может синтезироваться в организме человека и должен поступать в него с пищей. Участвует в энергетическом обмене. При недостаточности ферментов, катализирующих декарбоксилирование изолейцина, возникает кетоацидоз.

Лейцин (сокр. Leu или L; 2-амино-4-метилпентановая кислота; от греч. leukos — «белый») — алифатическая аминокислота с химической формулой HO2CCH(NH2)CH2CH(CH3)2. Имеет в своей структуре один хиральный центр и может существовать в виде D- или L-оптических изомера, а также в виде рацемата (смеси равных количеств D- и L-изомера). В живых организмах встречается в виде L-изомера.

Аминокисло́ты, также аминокарбо́новые кисло́ты, АМК — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот . Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
Глюконеогене́з — метаболический путь, приводящий к образованию глюкозы из неуглеводных соединений. Наряду с гликогенолизом, этот путь поддерживает в крови уровень глюкозы, необходимый для работы многих тканей и органов, в первую очередь, нервной ткани и эритроцитов. Он служит важным источником глюкозы в условиях недостаточного количества гликогена, например, после длительного голодания или тяжёлой физической работы. Глюконеогенез является обязательной частью цикла Кори, кроме того, этот процесс может быть использован для превращения пирувата, образованного при дезаминировании аминокислот аланина и серина.

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например, фотосинтетический комплекс и другие комплексы.

Фенилалани́н — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах l и d и в виде рацемата. По химическому строению соединение можно представить как аминокислоту аланин, в которой один из атомов водорода замещён фенильной группой.

Проли́н — гетероциклическая иминокислота, в которую атом азота входит в составе вторичного, а не первичного, амина. Существует в двух оптически изомерных формах — L и D, а также в виде рацемата.

Сери́н — гидроксиаминокислота, существует в виде двух оптических изомеров — L и D.

Гистиди́н — гетероциклическая альфа-аминокислота, одна из 20 протеиногенных аминокислот. По современным представлениям также является незаменимой кислотой как для детей, так и для взрослых.

Триптофа́н — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах, L и D, и в виде рацемата (DL).

Цистеи́н — алифатическая серосодержащая аминокислота. Оптически активна, существует в виде L- и D- изомеров. L-Цистеин входит в состав белков и пептидов, играет важную роль в процессах формирования тканей кожи. Имеет значение для дезинтоксикационных процессов.
Коллаге́н — гликопротеин, фибриллярный белок, составляющий основу соединительной ткани организма и обеспечивающий её прочность и эластичность. Коллаген обнаружен у животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих, составляющий от 25 % до 45 % белков во всём теле. Синтез коллагена очень энергозатратен и происходит только у животных, которые используют кислород. Появление коллагена позволило создать скелет, как внешний, так и внутренний, и резко увеличить размеры животных во время кембрийского взрыва.
Ферме́нты пищеваре́ния, пищеварительные ферменты — ферменты, расщепляющие сложные компоненты пищи (полисахариды) до более простых веществ (олигосахаридов), которые затем всасываются в организм. В более широком смысле пищеварительными ферментами также называют все ферменты, расщепляющие крупные молекулы на мономеры или более мелкие части. Все ферменты желудочно-кишечного тракта относятся к гидролазам, что означает, что расщепление пищевых полимеров происходит всегда при участии молекулы воды.
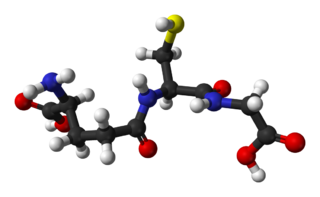
Глутатион — это трипептид γ-глутамилцистеинилглицин. Глутатион содержит необычную пептидную связь между аминогруппой цистеина и карбоксильной группой боковой цепи глутамата. Значение глутатиона в клетке определяется его антиоксидантными свойствами. Фактически глутатион не только защищает клетку от токсичных свободных радикалов, но и в целом определяет окислительно-восстановительные характеристики внутриклеточной среды.
Эласти́н — белок соединительной ткани, обладающий эластичностью.
Структурная функция белков заключается в том, что белки
- участвуют в образовании практически всех органоидов клеток, во многом определяя их структуру (форму);
- образуют цитоскелет, придающий форму клеткам и многим органоидам и обеспечивающий механическую форму ряда тканей;входят в состав межклеточного вещества, во многом определяющего структуру тканей и форму тела животных.

Аминокислоты с разветвлёнными боковыми цепями — группа протеиногенных аминокислот, характеризующихся разветвлёнными строением алифатической боковой цепи. К таким аминокислотам относятся лейцин, изолейцин и валин.
Углеводный обмен, или метаболизм углеводов в организмах животных и человека. Метаболизм углеводов в организме человека состоит из следующих процессов:
- Расщепление в пищеварительном тракте поступающих с пищей поли- и дисахаридов до моносахаридов, дальнейшее всасывание моносахаридов из кишечника в кровь.
- Синтез и распад гликогена в тканях, прежде всего в печени.
- Гликолиз — распад глюкозы. Первоначально под этим термином обозначали только анаэробное брожение, которое завершается образованием молочной кислоты (лактата) или этанола и углекислого газа. В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глюкозо-6-фосфата, фруктозо-1,6-дифосфата и пирувата как в отсутствие, так и в присутствии кислорода. В последнем случае употребляется термин «аэробный гликолиз», в отличие от «анаэробного гликолиза», завершающегося образованием молочной кислоты или лактата.
- Анаэробный путь прямого окисления глюкозы или, как его называют, пентозофосфатный путь.
- Взаимопревращение гексоз.
- Анаэробный метаболизм пирувата. Этот процесс выходит за рамки углеводного обмена, однако может рассматриваться как завершающая его стадия: окисление продукта гликолиза — пирувата.
- Глюконеогенез — образование углеводов из неуглеводных продуктов.
Непротеиногенные аминокислоты — аминокислоты, которые не участвуют в биосинтезе белка. Непротеиногенные аминокислоты часто не входят в состав непатогенных и «нормальных» белков человека, не следует их путать с нестандартными аминокислотами, которые образуются непосредственно при синтезе белка или в результате различных ковалентных модификаций молекулярных структур протеиногенных (кодируемых) аминокислот в составе белков, например, гидроксипролина, десмозина или аллизина. Однако они могут входить в состав некоторых небольших молекул или пептидов, синтез которых является нерибосомальным. Химически синтезированные аминокислоты можно назвать неприродными аминокислотами. Многие из них являются токсинами и ингибиторами ферментов разнообразных метаболических реакций. Известно свыше 400 природных аминокислот и, возможно, больше тысячи их комбинаций. Неприродные аминокислоты могут быть синтетически получены из их нативных аналогов с помощью модификаций, таких как алкилирование аминогруппы, замещение боковой цепи, циклизация за счёт удлинения структурных связей и изостерических замен в аминокислотном остове.
















