
Митохо́ндрия — двумембранная сферическая или эллипсоидная органелла диаметром обычно около 1 микрометра. Характерна для большинства эукариотических клеток, как автотрофов, так и гетеротрофов. Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии для генерации электрического потенциала, синтеза АТФ и термогенеза. Эти три процесса осуществляются за счёт движения электронов по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют. В специализированных клетках органов животных содержатся сотни и даже тысячи митохондрий.

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например, фотосинтетический комплекс и другие комплексы.
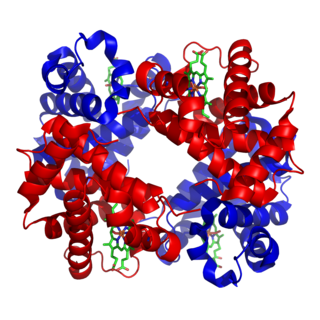
Глобулярные белки́ — белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры — глобулы.

Денатурация белков — изменение нативной конформации белковой молекулы под действием различных дестабилизирующих факторов. Аминокислотная последовательность белка не изменяется. Приводит к потере белками их естественных свойств.
Биополиме́ры — класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды, лигнин. Биополимеры состоят из одинаковых звеньев — мономеров. Мономеры белков — аминокислоты, нуклеиновых кислот — нуклеотиды, в полисахаридах — моносахариды.

Нуклеи́новая кислота — высокомолекулярное органическое соединение, биополимер (полинуклеотид), образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
Коллаге́н — гликопротеин, фибриллярный белок, составляющий основу соединительной ткани организма и обеспечивающий её прочность и эластичность. Коллаген обнаружен у животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих, составляющий от 25 % до 45 % белков во всём теле. Синтез коллагена очень энергозатратен и происходит только у животных, которые используют кислород. Появление коллагена позволило создать скелет, как внешний, так и внутренний, и резко увеличить размеры животных во время кембрийского взрыва.
Склеропротеины или фибриллярные белки — один из трёх основных типов белков различающихся по форме белковых молекул. Находятся в организмах в твёрдом или пластическом состоянии, выполняют преимущественно-структурную функцию, обеспечивают механическую прочность органов, защищают от воздействий внешней среды, а также образуют опорные сетчатые структуры внутри клеток и мембран, влияя на проницаемость последних.

В биохимии и молекулярной биологии фо́лдингом белка называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру.
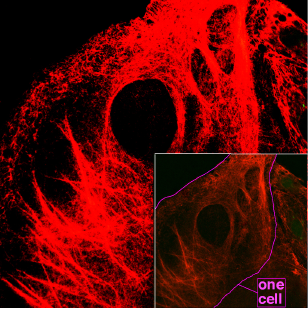
Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога носорогов, перья и рамфотека клюва птиц и др.
Вторичная структура — конформационное расположение главной цепи макромолекулы, независимо от конформации боковых цепей или отношения к другим сегментам. В описании вторичной структуры важным является определение водородных связей, которые стабилизируют отдельные фрагменты макромолекул.
Вторичные посредники, или «вторичные мессенджеры» — это внутриклеточные сигнальные молекулы, высвобождаемые в тех или иных внутриклеточных сигнальных каскадах в ответ на стимуляцию тех или иных рецепторов и вызванную ею активацию первичных эффекторных белков. Вторичные посредники, в свою очередь, приводят к активации вторичных эффекторных белков. Это, в свою очередь, запускает каскад тех или иных физиологических изменений, которые могут быть важны для обеспечения таких важных физиологических процессов, как рост, развитие и дифференцировка клеток, активация деления клетки, транскрипция или, наоборот, угнетение транскрипции тех или иных генов, биосинтез тех или иных белков, выделение ею гормонов, нейромедиаторов или цитокинов соответственно типу клетки, изменение биоэлектрической активности клетки, миграция клеток, обеспечение их выживаемости или, наоборот, индукция апоптоза. Вторичные посредники являются инициирующими элементами во множестве внутриклеточных сигнальных каскадов. Вследствие всего этого вторичные посредники играют очень важную роль в жизни клетки, а грубое нарушение работы любой из систем вторичных посредников оказывает неблагоприятное воздействие на клетку.
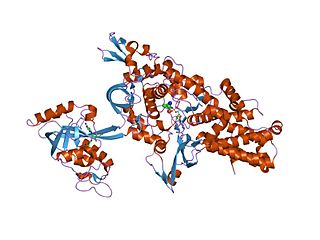
Аминоацил-тРНК-синтетаза (АРСаза) — фермент (синтетаза), катализирующий образование аминоацил-тРНК в реакции этерификации определённой аминокислоты с соответствующей ей молекулой тРНК. Для каждой протеиногенной аминокислоты существует по меньшей мере одна аминоацил-тРНК-синтетаза.
Структурная функция белков заключается в том, что белки
- участвуют в образовании практически всех органоидов клеток, во многом определяя их структуру (форму);
- образуют цитоскелет, придающий форму клеткам и многим органоидам и обеспечивающий механическую форму ряда тканей;входят в состав межклеточного вещества, во многом определяющего структуру тканей и форму тела животных.

β-Лист — одна из форм регулярной вторичной структуры белков, немного более редкая, чем альфа-спираль. Бета-листы состоят из бета-цепей (нитей), связанных с боков двумя или тремя водородными связями, образуя слегка закрученные, складчатые листы.
Предсказа́ние структу́ры белка́ — направление молекулярного моделирования, предсказание по аминокислотной последовательности трёхмерной структуры белка. Данная задача является одной из самых важных целей биоинформатики и теоретической химии. Данные, полученные при помощи предсказания, применяются в медицине и биотехнологии при создании новых ферментов. Для лучших результатов сочетают несколько программ и методов.

Четвертичная структура — способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования. Специфичность четвертичной структуры белков проявляется в определенной конформационной автономии полипептидных фрагментов, входящих в состав макромолекулы белка. Вклад гидрофобных взаимодействий в стабилизацию третичной и четвертичной структуры белков весьма значителен: в случае третичной структуры на их долю приходится больше половины стабилизирующей силы.

Интегральный мембранный белок — один из типов мембранных белков, которые прочно связаны с цитоплазматической мембраной (интегрированы). Они составляют значительную часть белков, закодированных в геноме любого организма. Интегральные белки могут быть погружены в мембрану полностью, а иногда даже пронизывают её насквозь. В этом смысле, все трансмембранные белки являются интегральными белками, но не все интегральные — трансмембранными. Связь интегральных белков с мембранными липидами очень прочна и определяется главным образом гидрофобными взаимодействиями.

Олег Борисович Птицын — советский и российский учёный, работавший в области физики полимеров, физики белка, молекулярной биологии и белковой инженерии, доктор физико-математических наук, профессор Московского физико-технического института и Института биофизики АН СССР, член Европейской академии наук, член Нью-Йоркской академии наук.

Спираль 310 (спираль 3.10) — тип вторичной структуры, встречающийся в белках и полипептидах. Из множества присутствующих вторичных структур белка 310-спираль является четвёртым наиболее часто наблюдаемым типом после α-спиралей, β-листов и β-поворотов. 310-спирали составляют почти 15-20 % от всех спиралей во вторичных структурах белков и обычно наблюдаются как продолжения α-спиралей, обнаруживаемые либо на их N-, либо на C-концах. 310-спирали в белках обычно имеют длину всего от трёх до пяти остатков по сравнению со средним значением 10-12 остатков для α-спиралей. Из-за тенденции α-спиралей к последовательному сворачиванию и разворачиванию было предложено, что 310-спираль служит своего рода промежуточной конформацией при сворачивании/разворачивании α-спиралей.













