Трифторбромметан
| Трифторбромметан | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование | Трифторбромметан | ||
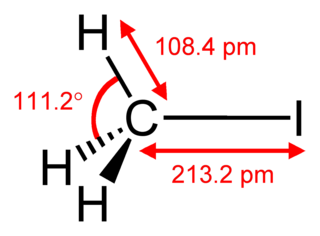
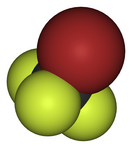
| Хим. формула | CBrF3 | ||
| Физические свойства | |||
| Состояние | газообразный | ||
| Молярная масса | 148,909 г/моль | ||
| Плотность | 6,77 г/см³ | ||
| Энергия ионизации | 11,78 ± 0,01 эВ[1] и 11,4 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −168 °C | ||
| • кипения | −58 °C | ||
| Давление пара | 1 ± 1 атм[1] | ||
| Структура | |||
| Дипольный момент | 2,2E−30 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | 75-63-8 | ||
| PubChem | 6384 | ||
| Рег. номер EINECS | 200-887-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | PA5425000 | ||
| Номер ООН | 1009 | ||
| ChemSpider | 6144 | ||
| Безопасность | |||
| Пиктограммы СГС | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бромтрифтормета́н (также известный как галон 1301) — органическое соединение с формулой CBrF3, производное метана, полностью замещённый галогеналкан. При нормальных условиях — негорючий прозрачный газ.
Производство
Бромтрифторметан может быть получен путём взаимодействия трифторметана с бромом.
Таблица физических свойств
| свойства | значения |
|---|---|
| Критическая температура(Тс) | 66,9 °C (340,08 K) |
| Критическое давление(pc) | 3,956 МПа (39,56 бар) |
| Критическая плотность(ρc) | 5,13 моль/л |
| Потенциал истощения озонового слоя (ODP) | 10 (CCl3F = 1) |
| Потенциал глобального потепления (GWP) | 6900 (CO2 = 1) |
Использование
Бромтрифторметан был введён в качестве средства пожаротушения в 1960-х годах. Бромтрифторметан тушит пожары в концентрации 6 %, вмешиваясь в радикальную реакцию горения. Относится к группе галогенированных углеводородов, вредных для озонового слоя и запрещённых Монреальским протоколом. Их производство в промышленно развитых странах (в частности, в Европейском Союзе) запрещено. Тем не менее, применение в соответствии с международным правом по-прежнему разрешено.
- Химический реагент
Бромтрифторметан является прекурсором трифторметилтриметилсилана, популярного трифторметилирующего реагента в органическом синтезе.
Токсикология и безопасность
Трифторбромметан разлагается при контакте с горячей поверхностью или с пламенем, образуя токсичные пары, включая бромистый водород и фтористый водород (продукты пиролиза). Бромтрифторметан очень агрессивно реагирует со щелочными металлами.
Вещество раздражает глаза. Быстрое испарение жидкости может вызвать обморожение. Пары могут оказывать влияние на центральную нервную систему.
Литература
- Основные факты о галоне Архивная копия от 20 октября 2020 на Wayback Machine
- Статья FAA о испытательных баллонах, используемых для хранения галонов 1301 без нарушения их уплотнений
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0634.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5