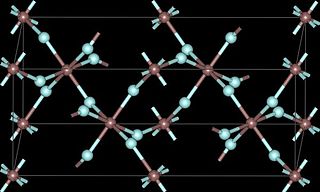
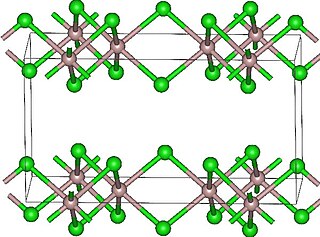
Трихлориды лантаноидов
Трихлориды лантаноидов — группа неорганических соединений с формулой LnCl3, где Ln обозначает металл-лантаноид. Трихлориды являются стандартными реагентами в исследовательской и прикладной химии лантаноидов. Существуют в виде безводных твёрдых веществ и в виде гидратов.
Свойства
Безводные твёрдые вещества имеют диапазон температур плавления от ок. 582 (Tb) до 925°С (Lu). Обычно они бледного цвета, часто — белые. Как координационные полимеры они растворяются только в донорных растворителях, в том числе в воде.
| МСВ3 | цвет | тип структуры | f-конфигурация | комментарий |
|---|---|---|---|---|
| ScCl3 | бесцветный | тип AlCl3 | f0 | обычно не классифицируется как лантаноид |
| YCl3 | бесцветный | тип AlCl3 | f0 | обычно не классифицируется как лантаноид |
| LaCl3 | бесцветный | тип UCl3 | f0 | диамагнитен |
| CeCl3 | бесцветный | тип UCl3 | f1, дублет | - |
| PrCl3 | зелёный | тип UCl3 | f2, триплет | - |
| NdCl3 | розовый | тип UCl3 | f3, квартет | - |
| PmCl3 | зелёный | тип UCl3 | f4, квинтет | радиоактивен |
| SmCl3 | жёлтый | тип UCl3 | f5, секстет | - |
| EuCl3 | жёлтый | тип UCl3 | f6, септет | - |
| GdCl3 | бесцветный | тип UCl3 | f7, октет | симметричная электронная оболочка |
| TbCl3 | белый | тип PuBr3 | f8, септет | - |
| DyCl3 | белый | тип AlCl3 | f9, секстет | - |
| HoCl3 | жёлтый | тип AlCl3 | f10, квинтет | - |
| ErCl3 | фиолетовый | тип AlCl3 | f11, квартет | - |
| TmCl3 | жёлтый | тип AlCl3 | f12, триплет | - |
| YbCl3 | бесцветный | тип YCl3 | f13, дублет | - |
| LuCl3 | бесцветный | тип AlCl3 | f14 | диамагнитен |
Получение
Оксиды и карбонаты лантаноидов растворяются в соляной кислоте с образованием хлоридной соли гидратированных катионов:
- M2O3 + 6 HCl + n H2O → 2 [Ln(H2O)n]Cl3
В промышленности
Безводные трихлориды производятся в промышленных масштабах путём карботермической реакции оксидов:[2]
- M2O3 + 3 Cl2 + 3 C → 2 MCl3 + 3 CO
С помощью хлорида аммония
Способ получения с помощью хлорида аммония относится к общей процедуре получения безводных хлоридов лантаноидов. Преимущество этого метода заключается в том, что он является общим для 14 лантаноидов и позволяет получать стабильные на воздухе промежуточные соединения, устойчивые к гидролизу. Использование хлорида аммония в качестве реагента удобно, поскольку соль получается безводной даже при работе на воздухе. Хлорид аммония также практичен, поскольку он термически разлагается на летучие продукты при температурах, совместимых со стабильностью трихлоридных солей.[3][4][5]
- Шаг 1
- получение лантаноидаммонийхлоридов
Реакция однородной смеси оксидов лантаноидов с избытком хлорида аммония приводит к образованию безводных аммониевых солей пента- и гексахлоридов. Типичными условиями реакции являются несколько часов при 230—250 °C.[6] Некоторые лантаноиды (а также скандий и иттрий) образуют пентахлориды:
- М2О3 + 10 NH4Cl → 2 (NH4)2МСВ5 + 3 Н2О + 6 НХ3
(M = Dy, Ho, Er, Tm, Yb, Lu, Y, Sc)
- Tb4О7 + 22 NH4Cl → 4 (NH4)2TbCl5 + 7 Н2О + 14 НХ3
Другие лантаноиды образуют гексахлориды:
- M2О3 + 12 NH4Cl → 2 (NH4)3MCl6 + 3 Н2О + 6 НХ3
(M = La, Ce, Nd, Pm, Sm, Eu, Gd)
- Pr6О11 + 40 NH4Cl → 6 (NH4)3PrCl6 + 11 Н2О + 22 НХ3
Эти реакции также можно проводить и с металлами, например:[6]
- Y + 5 NH4Cl → (NH4)2YCl5 + 1,5 Н 2 + 3 НХ3
- Шаг 2
- термолиз лантаноидаммонийхлоридов
Лантаноидаммонийхлориды превращают в трихлориды с помощью нагревания в вакууме. Типичные температуры реакции — 350—400°C:[6]
- (NH4)2MCl5 → MCl3 + 2 HCl + 2 НХ3
- (NH4)3MCl6 → MCl3 + 3 HCl + 3 НХ3
Прочие методы
Гидратированные трихлориды лантаноидов получают безводные в токе хлороводорода.[7]
Строение

Как указано в таблице, безводные трихлориды соответствуют двум основным мотивам, UCl3 и YCl3. Структура UCl3 имеет 9-координированные металлические центры. Структура PuBr3, уникальная для TbCl3, содержит 8-координированные металлы. Другие более поздние металлы 6-коордированы, как и трихлорид алюминия.[9]
Реакции
Трихлориды лантаноидов являются коммерческими прекурсорами металлов путём восстановления, например, алюминием:[10]
- LnCl3 + Al → Ln + AlCl3
В некоторых случаях предпочтительны трифториды.
Они реагируют с влажным воздухом с образованием оксихлоридов:
- LnCl3 + H2O → LnOCl + 2 HCl
Для синтетической химии эта реакция проблематична, поскольку оксихлориды менее реакционноспособны.
Примечания
- ↑ Greenwood N. N., Earnshaw A. Chemistry of the Elements (англ.). — 2nd Ed. — Butterworth-Heinemann[англ.], 1997. — ISBN 0-08-037941-9.
- ↑ I. McGill. Rare Earth Elements // Ullmann's Encyclopedia of Industrial Chemistry[англ.] (англ.). — Weinheim: Wiley-VCH, 2005. — doi:10.1002/14356007.a22_607.
- ↑ Handbook of Preparative Inorganic Chemistry / Brauer, G.. — 2nd. — New York : Academic Press, 1963.
- ↑ Meyer, G. The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides-The Example of YCl3. — 1989. — Vol. 25. — P. 146–150. — ISBN 978-0-470-13256-2. — doi:10.1002/9780470132562.ch35.
- ↑ Edelmann, F. T. Synthetic Methods of Organometallic and Inorganic Chemistry / F. T. Edelmann, Poremba, P.. — Stuttgart : Georg Thieme Verlag, 1997. — Vol. VI. — ISBN 978-3-13-103021-4.
- ↑ 1 2 3 Meyer, G. The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides-The Example of YCl3. — 1989. — Vol. 25. — P. 146–150. — ISBN 978-0-470-13256-2. — doi:10.1002/9780470132562.ch35.Meyer, G. (1989). The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides-The Example of YCl3. Inorganic Syntheses. Vol. 25. pp. 146—150. doi:10.1002/9780470132562.ch35. ISBN 978-0-470-13256-2.
- ↑ Handbook of Preparative Inorganic Chemistry / Brauer, G.. — 2nd. — New York : Academic Press, 1963.Brauer, G., ed. (1963). Handbook of Preparative Inorganic Chemistry (2nd ed.). New York: Academic Press.
- ↑ Habenschuss, A.; Spedding, F. H. (1980). "Dichlorohexaaquagadolinium(III) Chloride (GdCl2(H2O)6)C". Crystal Structure Communications. 9.
{{cite journal}}: Википедия:Обслуживание CS1 (множественные имена: authors list) (ссылка) - ↑ Cotton, Simon A. Scandium, Yttrium & the Lanthanides: Inorganic & Coordination Chemistry // Encyclopedia of Inorganic and Bioinorganic Chemistry. — 2011. — ISBN 9781119951438. — doi:10.1002/9781119951438.eibc0195.
- ↑ Rare Earth Elements // Ullmann's Encyclopedia of Industrial Chemistry[англ.] (англ.). — Weinheim: Wiley-VCH, 2005. — doi:10.1002/14356007.a22_607.I. McGill (2005). «Rare Earth Elements». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_607.