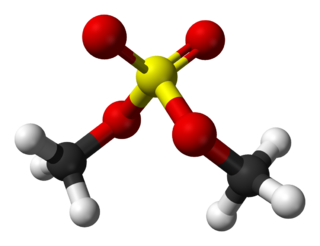
Триэтилфосфит
| Триэтилфосфит[1][2][3] | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Триэтилфосфит | ||
| Традиционные названия | Этилфосфит, триэтоксифосфин[4] | ||
| Хим. формула | C6H15O3P | ||
| Рац. формула | (C2H5O)3P | ||
| Физические свойства | |||
| Состояние | Бесцветная жидкость | ||
| Молярная масса | 166.16 г/моль | ||
| Плотность | 0,9687 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -112 °C | ||
| • кипения | 156,5 °C | ||
| • самовоспламенения | 250 °C | ||
| Оптические свойства | |||
| Показатель преломления | 1,4135 | ||
| Классификация | |||
| Рег. номер CAS | 122-52-1 | ||
| PubChem | 31215 | ||
| Рег. номер EINECS | 204-552-5 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 28956 | ||
| Безопасность | |||
| Краткие характер. опасности (H) | H226, H317, H412 | ||
| Меры предостор. (P) | P210, P233, P240, P241, P242, P243, P261, P272, P280 | ||
| Сигнальное слово | Осторожно | ||
| Пиктограммы СГС | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Триэтилфосфит (этилфосфит) — фосфорорганическое соединение, этиловый эфир фосфористой кислоты. Бесцветная жидкость.
Получение
- Основным способом получения является реакция между хлоридом фосфора(III), этиловым спиртом и диэтиланилином, поглощающим выделяющийся хлороводород. В колбу помещается равное число моль абсолютного этанола и диэтиланилина, а также петролейный эфир в качестве реакционной среды. Колба охлаждается, после чего при сильном перемешивании в неё вливается раствор хлорида фосфора(III) в петролейном эфире таким образом, чтобы число моль добавленного трихлорида было в три раза меньше, чем этанола. Смесь перемешивается и нагревается в течение 1 часа. После этого суспензию хлористоводородной соли диэтиламина отделяют, а растворитель отгоняют на водяной бане. Остаток перегоняют в вакууме и получают триэтилфосфит с выходом 83 %. При этом протекает следующая реакция:
- В данном методе могут использоваться другие амины, к примеру, диметиланилин или пиридин. Однако диэтиланилин обладает преимуществом, поскольку его гидрохлорид, образующийся в ходе реакции, легко фильтруется и не является гигроскопичным[5].
- Взаимодействие этилята натрия или магния с хлоридом фосфора(III) в среде безводного эфира[6]:
Физические свойства
Триэтилфосфит представляет собой бесцветную жидкость. Растворим в органических растворителях, к примеру, этаноле или эфире, не растворим в воде[2].
Химические свойства
- Является восстановителем. В окислительно-восстановительных реакциях окисляется преимущественно до триэтилфосфата. Особенно эффективно восстанавливает органические пероксиды:
- Данная реакция протекает настолько быстро, что трет-бутоксильный радикал не успевает разложиться и образовать трет-бутанол или ацетон. Он диспропорционирует, образуя изобутан и изобутилен[7].
- Восстанавливает окись этилена до этилена при нагревании до 174 °C в атмосфере азота при давлении 3,5 атм[8]:
- Способен поглощать серу из 1,2-эпитиоалканов, что успешно используется в органическом синтезе:
- Отщепление серы протекает стереоспецифично, то есть из цис-эписульфида образуется цис-алкен, а из транс-эписульда — транс-алкен[9].
- Последовательно восстанавливает ароматические нитросоединения сначала до нитрозосоединений, а затем до нитренов[10]:
- Гидролизуется с образованием этилового спирта и фосфористой кислоты:
- Вступает в реакцию Арбузова, образуя эфир алкилфосфоновой кислоты[6]:
- Вступает в реакцию Перкова. К примеру, с хлоралем образует О,О-диэтил-О-(2,2-дихлорвинил)фосфат[11]:
- С некоторыми спиртами способен образовывать бициклические фосфиты. К примеру, с триметилолэтаном при температуре 100 °C с выходом продукта 90 %[12]:
Применение
Промежуточный продукт в синтезе многих органических веществ, в частности, лекарств, пестицидов и инсектицидов под названиями О,О-диэтил-О-(2,2-дихлорвинил)фосфат, Шелл OS-1836, Форстенон; применяется для получения п-цимола из природной эндо-перекиси аскаридола[10][13].
Является компонентом смазочных материалов[2].
Широко применяется в органическом синтезе в качестве катализатора. К примеру, катализирует димеризацию кетена в β-лактон, реакции дегалогенирования и внутримолекулярного присоединения, что используется для получения гексахлорфульвена и карбазола[14].
Примечания
- ↑ Triethylphosphite (англ.). Sigma-Aldrich.
- ↑ 1 2 3 Кнунянц и др., 1998, с. 598—599.
- ↑ Никольский и др., 1971, с. 1146—1147.
- ↑ Триэтилфосфит иногда можно рассматривать как производное фосфина, где атомы водорода у него заменены на три этокси-группы
- ↑ Платэ, 1953, с. 492—493.
- ↑ 1 2 Жиряков, 1974, с. 135.
- ↑ Хавкинс, 1964, с. 264.
- ↑ Зимаков и др., 1967, с. 80.
- ↑ Бюлер и др., 1973, с. 116.
- ↑ 1 2 Физер, 1971, с. 469—470.
- ↑ Шрадер, 1965, с. 52.
- ↑ Физер, 1966, с. 458.
- ↑ Шрадер, 1965, с. 52, 60, 63.
- ↑ Физер, 1978, с. 577.
Литература
- Большой энциклопедический словарь. Химия / Редкол.: Кнунянц И.Л. и др. — 2-е изд. — М.: Советская энциклопедия, 1998. — 791 с. — ISBN 5-85270-253-6.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Синтезы органических препаратов. Сборник 4 / пер. с англ. А.Ф. Платэ. — М.: Издательство иностранной литературы, 1953. — 659 с.
- Э. Дж. Э. Хавкинс. Органические перекиси, их получение и реакции / пер. с англ. Ю.Л. Московича, С.Д. Разумовского, Б.Г. Фрейдина. — М.: Химия, 1964. — 536 с.
- Л. Физер, М. Физер. Реагенты для органического синтеза / пер. с англ. З.Е. Самойловой. — М.: Мир, 1971. — Т. 5.
- Л. Физер, М. Физер. Реагенты для органического синтеза / пер. с англ. Т.П. Толстой. — М.: Мир, 1978. — Т. 7.
- Зимаков П.В., Дымент О.Н., Богословский Н.А. и др. Окись этилена. — М.: Химия, 1967. — 320 с.
- Л. Физер, М. Физер. Органическая химия. Углублённый курс. — М.: Химия, 1966. — Т. 1. — 680 с.
- В.Г. Жиряков. Органическая химия. — 5-е изд., испр. и доп.. — М.: Химия, 1974. — 408 с.
- Г. Шрадер. Новые фосфорорганические инсектициды / пер. с нем. А.Г. Зенькевич, Я.А. Мандельбаума, К.Д. Швецовой-Шиловской. — М.: Мир, 1965. — 478 с.
- К. Бюлер, Д. Пирсон. Органические синтезы. Часть 1 / пер. с англ. А.Ф. Платэ и М.П. Тетериной. — М.: Мир, 1973. — 622 с.