Углерод
| Углерод | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Бор | Азот → | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Внешний вид простого вещества | ||||||||||||||||||||||||||
 прозрачный (алмаз), матово-чёрный (графит) | ||||||||||||||||||||||||||
| Свойства атома | ||||||||||||||||||||||||||
| Название, символ, номер | Углеро́д / Carboneum (С), 6 | |||||||||||||||||||||||||
| Группа, период, блок | 14 (устар. 4), 2, p-элемент | |||||||||||||||||||||||||
| Атомная масса (молярная масса) | [12,0096; 12,0116][комм 1][1] а. е. м. (г/моль) | |||||||||||||||||||||||||
| Электронная конфигурация | [He] 2s22p2 1s22s22p2 | |||||||||||||||||||||||||
| Радиус атома | 70 пм | |||||||||||||||||||||||||
| Химические свойства | ||||||||||||||||||||||||||
| Ковалентный радиус | 77,0 пм | |||||||||||||||||||||||||
| Радиус иона | 16 (+4e) 260 (−4e) пм | |||||||||||||||||||||||||
| Электроотрицательность | 2,55[2] (шкала Полинга) | |||||||||||||||||||||||||
| Степени окисления | −4[3], −3, −2, −1, 0, +1[4], +2, +3[5], +4 | |||||||||||||||||||||||||
| Энергия ионизации (первый электрон) | 1085,7 (11,25) кДж/моль (эВ) | |||||||||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||||||||
| Плотность (при н. у.) | 2,24 (графит) г/см³ | |||||||||||||||||||||||||
| Критическая точка | 4600 [6] К, 10,8[6] МПа | |||||||||||||||||||||||||
| Молярная теплоёмкость | 8,54 (графит)[7] Дж/(K·моль) | |||||||||||||||||||||||||
| Молярный объём | 5,3 см³/моль | |||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||||||||
| Структура решётки | Гексагональная (графит/графен), Кубическая (алмаз) | |||||||||||||||||||||||||
| Параметры решётки | a = 2,46 Å; c = 6,71 Å (графит); а = 3,567 Å (алмаз) | |||||||||||||||||||||||||
| Отношение c/a | 2,73 (графит) | |||||||||||||||||||||||||
| Температура Дебая | 1860 (алмаз) K | |||||||||||||||||||||||||
| Прочие характеристики | ||||||||||||||||||||||||||
| Теплопроводность | (300 K) 1,59 Вт/(м·К) | |||||||||||||||||||||||||
| Номер CAS | 7440-44-0 | |||||||||||||||||||||||||
| Эмиссионный спектр | ||||||||||||||||||||||||||
| Наиболее долгоживущие изотопы | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| 6 | Углерод |
| 1s² 2s² 2p² | |
Углеро́д (химический символ — C, от лат. Сarboneum) — химический элемент четырнадцатой группы второго периода (по устаревшей классификации — главной подгруппы четвёртой группы, IVA) периодической системы химических элементов Д. И. Менделеева с атомным номером 6.
Три изотопа данного элемента встречаются в окружающем нас мире. Изотопы 12C и 13C являются стабильными, в то время как 14C радиоактивный (период полураспада данного изотопа составляет 5730 лет). Углерод был известен ещё в античном мире.
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, называемых органическими, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Благодаря лёгкости и прочности, материалы на основе углерода (например, различные углепластики) широко востребованы современной промышленностью.
История
Углерод в виде древесного угля применялся в древности для выплавки металлов. Издавна известны аллотропные модификации углерода: алмаз и графит.
На рубеже XVII—XVIII вв. возникла теория флогистона, выдвинутая Иоганном Бехером и Георгом Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества — невесомого флюида — флогистона, улетучивающегося в процессе горения. Так как при сгорании большого количества угля остается лишь немного золы, флогистики полагали, что уголь — это почти чистый флогистон. Именно этим объясняли, в частности, «флогистирующее» действие угля, — его способность восстанавливать металлы из «известей» и руд. Поздние флогистики (Реомюр, Бергман и другие) уже начали понимать, что уголь представляет собой элементарное вещество. Однако впервые таковым «чистый уголь» был признан Антуаном Лавуазье, исследовавшим процесс сжигания в воздухе и кислороде угля и других веществ. В книге Гитона де Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur). Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье.
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Ещё в 1751 году германский император Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что алмаз представляет собой кристаллический углерод. Второй аллотроп углерода — графит — в алхимическом периоде считался видоизменённым свинцовым блеском и назывался plumbago; только в 1740 году Потт обнаружил отсутствие в графите какой-либо примеси свинца. Шееле исследовал графит (1779) и, будучи флогистиком, счёл его сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона.
Двадцать лет спустя Гитон де Морво путём осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту[8].
Происхождение названия
В XVII—XIX веках в русской химической и специализированной литературе иногда применялся термин «углетвор» (Шлаттер, 1763; Шерер, 1807; Севергин, 1815); с 1824 года Соловьёв ввёл название «углерод». Соединения углерода имеют в названии часть карбо(н) — от лат. carbō (род. п. carbōnis) «уголь».
Физические свойства

Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать ковалентные химические связи разного типа.
Углерод имеет самую высокую температуру сублимации среди всех известных веществ. При атмосферном давлении он не имеет точки плавления, так как его тройная точка 10,8±0,2 МПа (106,6 ± 2,0 атм) и 4600±300 К (4330±300 °C), поэтому он возгоняется при температуре около 3900 К (3630 °C)[10][11].
Изотопы углерода
Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С (1,07 %) и одного радиоактивного изотопа 14С (β-излучатель, Т½ = 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции: 14N (n, p) 14C, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
На образовании и распаде 14С основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
Аллотропные модификации углерода
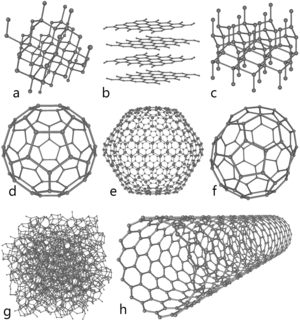
a: алмаз, b: графит, c: лонсдейлит
d: фуллерен — бакибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
Кристаллический углерод
- Алмаз
- Графен
- Графит
- Карбин
- Лонсдейлит
- Наноалмаз
- Фуллерены
- Фуллерит
- Углеродное волокно
- Углеродные нановолокна
- Углеродные нанотрубки
Аморфный углерод
- Активированный уголь
- Древесный уголь
- Ископаемый уголь: антрацит и ископаемый уголь.
- Кокс каменноугольный, нефтяной и др.
- Стеклоуглерод
- Технический углерод
- Сажа
- Углеродная нанопена
На практике, как правило, перечисленные выше аморфные формы являются химическими соединениями с высоким содержанием углерода, а не чистой аллотропной формой углерода.
Кластерные формы
Структура
Электронные орбитали атома углерода могут иметь различную форму в зависимости от степени гибридизации его электронных орбиталей. Существует три основных конфигурации атома углерода:
- тетраэдрическая, образуется при смешении одного s- и трёх p-электронов (sp3-гибридизация). Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными σ-связями с атомами углерода или иными расположенными в вершинах тетраэдра. Такой геометрии атома углерода соответствуют аллотропные модификации углерода алмаз и лонсдейлит. Такой гибридизацией обладает углерод, например, в метане и других углеводородах.
- тригональная, образуется при смешении одной s- и двух p-электронных орбиталей (sp2-гибридизация). Атом углерода имеет три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу. Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости σ-связей, используется для образования π-связи с другими атомами. Такая геометрия углерода характерна для графита, фенола и др.
- дигональная, образуется при смешении одного s- и одного p-электронов (sp-гибридизация). При этом два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают π-связи. Углерод с такой геометрией атома образует особую аллотропную модификацию — карбин.
Графит и алмаз
Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. Термодинамический расчёт линии равновесия графит — алмаз на фазовой р, Т-диаграмме был выполнен в 1939 году О. И. Лейпунским[12]. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы метастабильны. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается очень быстро[13][14][15]. ΔН0 перехода — 1,898 кДж/моль. Прямой переход графита в алмаз происходит при 3000 K и давлении 11—12 ГПа. При нормальном давлении углерод сублимируется при 3780 K.
Жидкий углерод
Жидкий углерод существует только при определённом внешнем давлении. Тройные точки: графит — жидкость — пар Т = 4130 K, р = 10,7 МПа и графит — алмаз — жидкость Т ≈ 4000 K, р ≈ 11 ГПа. Линия равновесия графит — жидкость на фазовой р, Т-диаграмме обладает положительным наклоном, переходящим по мере приближения к тройной точке графит — алмаз — жидкость в отрицательный, что связано с уникальными свойствами атомов углерода создавать углеродные молекулы, состоящие из различного количества атомов (от двух до семи). Наклон линии равновесия алмаз — жидкость, в отсутствие прямых экспериментов в области очень высоких температур (более 4000—5000 K) и давлений (более 10—20 ГПа), долгие годы считался отрицательным. Проведённые японскими исследователями прямые эксперименты[16] и обработка полученных экспериментальных данных с учётом аномальности высокотемпературной теплоёмкости алмаза[17][18] показали, что наклон линии равновесия алмаз — жидкость положителен, то есть алмаз плотнее жидкого углерода (в расплаве он будет тонуть, а не всплывать как лёд в воде).
В мае 2019 года в журнале Physical Review Letters опубликована работа российских учёных из Объединенного института высоких температур РАН А. М. Кондратьева и А. Д. Рахеля, в которой физики впервые в мире детально изучили и измерили свойства жидкой формы углерода. Результаты физического эксперимента позволили получить новые данные, которые были недоступны исследователям в условиях компьютерного моделирования. Тонкая пластина высокоориентированного пиролитического графита с гексагональной осью, перпендикулярной его поверхности, была зажата между двумя пластинами особого материала и нагрета при давлении от 0,3 до 2,0 ГПа. Оказалось, что температура плавления графита при этих условиях составляет 6300-6700 К, что более чем на 1000 К выше значений, предсказанных теоретически и на математических моделях. Исследователи впервые в мире точно измерили физические показатели процесса плавления углерода и свойства его жидкой фазы (удельное сопротивление, энтальпию плавления, изохорную теплоёмкость и многие другие показатели этого вещества[19]. Они также обнаружили, что скорость звука в жидком углероде возрастает при уменьшении плотности[19][20][21][22].
Углерод III
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15—20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решёткой типа вюрцита — лонсдейлит (а = 0,252 нм, с = 0,412 нм, пространственная группа Р63/mmc), плотность 3,51 г/см³, то есть такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
В 1980-е годы в СССР было обнаружено, что в условиях динамической нагрузки углеродсодержащих материалов могут образовываться алмазоподобные структуры, получившие название ультрадисперсных алмазов (УДА). В настоящее время всё чаще применяется термин «наноалмазы». Размер частиц в таких материалах составляет единицы нанометров. Условия образования УДА могут быть реализованы при детонации взрывчатых веществ со значительным отрицательным кислородным балансом, например, смесей тротила с гексогеном. Такие условия могут быть реализованы также при ударах небесных тел о поверхность Земли в присутствии углеродсодержащих материалов (органика, торф, уголь и пр.). Так, в зоне падения Тунгусского метеорита в лесной подстилке были обнаружены УДА.
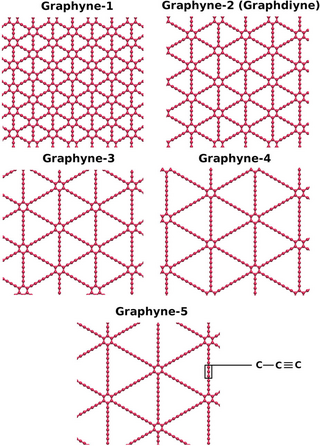
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (−C≡C−), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl4 в низкотемпературной плазме.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9—2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно или тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 1960-х годов в Институте элементоорганических соединений Академии наук СССР[23]. Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
Фуллерены и углеродные нанотрубки
Углерод известен также в виде кластерных частиц С60, С70, C80, C90, C100 и подобных (фуллерены), а также графенов, нанотрубок и сложных структур — астраленов.
Аморфный углерод (строение)
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, техуглерод, сажа, активированный уголь.
Графен
Графен — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp² связей в гексагональную двумерную кристаллическую решётку.
Углеродное кольцо
В 2019 году впервые синтезирован один экземпляр молекулы, представляющей собой кольцо из 18 атомов углерода. В нём чередуются одинарные и тройные химические связи[24][25].
Нахождение в природе
Было оценено, что Земля в целом состоит из 730 ppm углерода, с содержанием 2000 ppm в ядре и 120 ppm в мантии и коре[26]. Масса Земли составляет 5,972⋅1024 kg, что предполагает наличие 4360 миллионов гигатонн углерода.
Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~17,5 %).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоёв океанических вод, а также при дыхании, брожении, гниении. Биологический цикл состоит в том, что углерод в виде СО2 поглощается из тропосферы растениями в процессе фотосинтеза. Затем из биосферы он вновь возвращается в геосферу, частично через организмы животных и человека, и в виде СО2 — в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
В природе встречается минерал шунгит, в котором содержится как твёрдый углерод (≈25 %), так и значительные количества диоксида кремния (≈35 %).
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—501 °C, 600—700 °C и 800—1000 °C.
Степень окисления бывает от −4 до +4. Сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С0 к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует с неметаллами при нагревании.
| Реагент | Уравнение | Описание |
|---|---|---|
| | Продуктами горения углерода являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). Известен также неустойчивый недооксид углерода С3О2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например, C12O9, C5O2, C12O12). Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты. На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит). | |
| | | При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. Получен селенид углерода CSe2. |
| | | Из углерода можно получить метан в присутствии оксидов железа, однако гораздо практичнее получать метан из синтез газа. Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C[27], образуя фреон. |
| При сплавлении получается карбид кремния. | ||
| При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту: Такой же реакцией получают циан | ||
| Не реагирует |
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения.
| Уравнение | Описание |
|---|---|
| Важна в промышленности реакция углерода с водяным паром для получения синтез газа | |
| Горение чёрного пороха. | |
| | С калиевой селитрой углерод проявляет восстановительные свойства. |
| Восстанавливает сульфат бария | |
| | При сплавлении углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности. |
С большинством металлов углерод образует карбиды, например:
- (метанид)
- (ацетиленид)
Органические соединения
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры, углеводы и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Применение
Графит используют в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Также его используют в качестве смазки при особо высоких или низких температурах. Его невероятно высокая температура плавления позволяет делать из него тигли для заливки металлов. Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды.
Алмаз благодаря исключительной твёрдости — незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бурмашин. Кроме этого, огранённые алмазы — бриллианты — используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая себестоимость добычи алмазов ($97,47 за один карат[28]) и сложность обработки алмаза ограничивают его применение в этой области.
В фармакологии и медицине широко используются различные соединения углерода: производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности, углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля с XXIII века до н. э.[29] и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества. В первые века до н. э. в Юннани изготовили первый каменноугольный кокс, который в металлургии стал активно применяться, однако, лишь с конца XVIII века. Каменный уголь добывался ещё римлянами на Британских островах в качестве источника теплоэнергии. До XIII века для выплавки металлов в Европе применялся исключительно древесный уголь, а в XIII—XVII веках опыты применения каменного угля были неудачны ввиду его хрупкости в домнах. Лишь в 1735 г. металлургический процесс был впервые успешно применён исключительно на коксе. К концу XVIII в. практически все доменные печи Англии работали на каменноугольном коксе, в том числе благодаря изобретению паровой машины Уатта в 1784 г.
Гагат же (тот же уголь по происхождению) как поделочный камень известен даже более 25 веков.
Токсическое действие
Углерод поступает в окружающую среду в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5—0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)⋅109 Бк/сутки 14СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и лёгких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14С, вошедшего в состав биологических молекул (особенно в ДНК и РНК), определяется его радиационным взаимодействием с β-частицами (14С (β) → 14N), приводящим к изменению химического состава молекулы. Допустимая концентрация 14С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0⋅104 Бк/л, предельно допустимое поступление через органы дыхания 3,2⋅108 Бк/год.
См. также
- Категория:Соединения углерода
- Радиоуглеродный анализ
- Углеродный шовинизм
- Углеродная звезда
- Углеродная планета
Комментарии
- ↑ Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — ISSN 0033-4545. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Относительная электроотрицательность атома углерода зависит от состояния его гибридизации:
Csp3 = 2,5 (в большинстве таблиц)
Csp2 = 2,8
Csp1 = 3,2 (алкины)
Зурабян С. Э., Колесник Ю. А., Кост А. А. и др. Взаимное влияние атомов в молекуле // Органическая химия: Учебник (Учеб. лит. Для учащихся фарм. училищ) / под ред. Н. А. Тюкавкиной. — М.: Медицина, 1989. — Т. 1. — С. 36. — 432 с. — ISBN 5-225-00314-1. - ↑ Carbon: Binary compounds (англ.). Дата обращения: 6 декабря 2007. Архивировано 25 ноября 2007 года.
- ↑ Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical (англ.). Дата обращения: 6 декабря 2007. Архивировано из оригинала 16 февраля 2008 года.
- ↑ Fourier Transform Spectroscopy of the System of CP (англ.). Дата обращения: 6 декабря 2007. Архивировано из оригинала 16 февраля 2008 года.
- ↑ 1 2 Savvatimskiy, A (2005). "Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963—2003)". Carbon. 43 (6): 1115—1142. doi:10.1016/j.carbon.2004.12.027.
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ ChemNet. Углерод: история открытия элемента. Дата обращения: 14 марта 2016. Архивировано 14 марта 2016 года.
- ↑ J. H. Eggert; et al. (Nov 8, 2009). "Melting temperature of diamond at ultrahigh pressure". Nature Physics. 6: 40—43. doi:10.1038/nphys1438.
- ↑ Greenville Whittaker, A. (1978). "The controversial carbon solid−liquid−vapour triple point". Nature. 276 (5689): 695—696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0. S2CID 4362313.
- ↑ Zazula, J. M. (1997). "On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam" (PDF). CERN. Архивировано (PDF) 25 марта 2009. Дата обращения: 6 июня 2009.
- ↑ Лейпунский О. И. Об искусственных алмазах // Успехи химии. — Российская академия наук, 1939. — Вып. 8. — С. 1519—1534.
- ↑ Seal M. The effect of surface orientation on the graphitization of diamond. // Phis. Stat. Sol., 1963, v. 3, p. 658.
- ↑ Evans T. Changes produced by High Temperature Treatment of Diamond. // The Properties of Diamond. Academi Press, 1979, p. 403—424.
- ↑ Андреев В. Д.. Спонтанная графитизация и термодеструкция алмаза при Т > 2000 K // Физика твердого тела, 1999, т. 41, вып. 4, с. 695—201.
- ↑ Togaya M. Melting behaviors of carbon underhigh pressure // High Pressure Research, 1990, v. 4, p. 342. (12 AIRAPT Conf. Proc., 1989, Padeborn).
- ↑ Андреев В. Д.. Экспериментальные данные по плавлению алмаза и графита с учётом аномальности высокотемпературной теплоёмкости // Химическая физика, 2002, т. 21, № 9, с. 3—11.
- ↑ Андреев В. Д. Избранные проблемы теоретической физики. — Киев: Аванпост-Прим. — 2012. Архивировано 3 декабря 2013 года.
- ↑ 1 2 A. M. Kondratyev, A. D. Rakhel. Melting Line of Graphite // Physical Review Letters. — 2019-05-03. — Т. 122, вып. 17. — С. 175702. — doi:10.1103/PhysRevLett.122.175702.
- ↑ Российские физики первыми изучили свойства жидкого углерода. РИА Новости (14 мая 2019). Дата обращения: 14 мая 2019. Архивировано 14 мая 2019 года.
- ↑ Ученые впервые изучили свойства жидкого углерода в условиях физического эксперимента. ТАСС. Дата обращения: 14 мая 2019. Архивировано 14 мая 2019 года.
- ↑ Впервые исследованы свойства жидкого углерода. indicator.ru. Дата обращения: 14 мая 2019. Архивировано 14 мая 2019 года.
- ↑ V. I. Kasatochkin, A. M. Sladkov, et al., Dokl. Akad. Nauk SSSR, 177, No. 2, 358 (1967).
- ↑ ArXiv.org Katharina Kaiser, Lorel M. Scriven, Fabian Schulz, Przemyslaw Gawel, Leo Gross, Harry L. Anderson 19 august 2019 An sp-hybridized molecular carbon allotrope, cyclo[18]carbon Архивная копия от 18 декабря 2019 на Wayback Machine
- ↑ Максим Абаев. Углеродное кольцо // Наука и жизнь. — 2019. — № 9. — С. 63. Архивировано 4 сентября 2019 года.
- ↑ William F McDonough The composition of the Earth Архивировано 28 сентября 2011 года. in Earthquake Thermodynamics and Phase Transformation in the Earth's Interior (англ.). — 2000. — ISBN 978-0126851854.
- ↑ Р. А. Лидин. Химические свойства неорганических веществ. — Третье. — 2004. — С. 100. — 162 с.
- ↑ Минфин РФ. Минфин России: Россия в Кимберлийском процессе. Добыча алмазов в РФ с 01.01.2003г. minfin.ru (27 февраля 2015). — Статистические данные по добыче природных алмазов с 01.01.2003 по 31.12.2014 по результатам сортировки и первичной оценки. Дата обращения: 28 июня 2015. Архивировано 1 июля 2015 года.
- ↑ История кокса. Дата обращения: 9 августа 2024. Архивировано 9 августа 2024 года.
Литература
- Берёзкин В. И. Углерод: замкнутые наночастицы, макроструктуры, материалы. — СПб.: АРТЭГО, 2013. — 450 с. — ISBN 978-5-91014-051-0
- Бухаркина Т. В. Химия природных энергоносителей и углеродных материалов / Т. В. Бухаркина, Н. Г. Дигуров. — М.: РХТУ им. Д.И. Менделеева, 1999. — 195 с. — ISBN 5-7237-0139-8.
- Ола Д. А. Химия гиперкоординированного углерода = Hupercarbon chemistry / Ола Дж., Пракаш Г.К.С., Уильямс Р.Е. и др. Перевод с англ. В.И. Минкина. — М.: Мир, 1990. — 336 с. — ISBN 5-03-001451-9.
- Сладков А. М., Кудрявцев Ю. П. Алмаз, графит, карбин — аллотропные формы углерода // Природа. 1969. № 5. — С.37—44.
- Kirk — Othmer encyclopedia, 3 ed., vol.4, N.-Y., 1978, p. 556—709.
- Саранчук В. I., Ошовський В. В., Власов Г. О. Хімія і фізика горючих копалин. — Донецьк: Східний видавничий дім, 2003. 204 с.
- Роберт Хейзен. Симфония №6 Углерод и эволюция почти всего = Robert M. Hazen. Symphony in C: Carbon and the Evolution of (Almost) Everything / Анастасия Науменко. — М.: Альпина нон-фикшн, 2021. — 410 p. — ISBN 978-5-00139-283-5.
Ссылки
- Углерод на Webelements
- Углерод в Популярной библиотеке химических элементов
- Информация об углероде Архивная копия от 21 января 2011 на Wayback Machine
- Углерод Алексея Сладкова (недоступная ссылка с 21-05-2013 [4199 дней] — история, копия) — история открытия карбина
- Сладков А. М. Карбин — третья аллотропная форма углерода: Монография (под ред. Бубнова Ю. Н.)


![{\displaystyle {\ce {2C + O2 ->[t] 2CO ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b7c2636027a4c20758e63a83d27d0d988c6c290)
![{\displaystyle {\ce {2CO + O2 ->[t] 2CO2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af8c72055e2b016777e87fa2ad128fc887283704)



![{\displaystyle {\ce {C + 2S ->[t] CS2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/138bf493328505ee260f418cd9edcab795458207)
![{\displaystyle {\ce {C + 2Se ->[t] CSe2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/909b8c2f82f720dc1cd0d206e26e56553987610b)


![{\displaystyle {\ce {C + 2H2 ->[t, P, cat] CH4 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c6e170193c4b961643a7471fc0132c550b89222)
![{\displaystyle {\ce {C + 2F2 ->[>900{°}C] CF4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4bcebbfbf1a4a70ae07f61dd22f6c9de62254b48)

![{\displaystyle {\ce {C + Si ->[t] SiC}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0f1bc03b53f4b904f7e0ef2bbb28fdca657f9ba)

![{\displaystyle {\ce {2C + N2 ->[t] (CN)2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb04dbcf8294445ffcdb1754721bf4457deec5f3)
![{\displaystyle {\ce {NH3 + CH4 ->[Pt] HCN + 3H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e12f3fc2202b7de5786ac80af38746d333661bc)
![{\displaystyle {\ce {2NH3 + 2CH4 ->[Pt] (CN)2 + 7H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe27ad2d647e0cac91d0928e6b4990e772804024)

![{\displaystyle {\ce {C + H2O ->[t] CO ^ + H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f98da4cbb43b0993b0e06754d74889a91c14f5a)
![{\displaystyle {\ce {3C + S + 2KNO3 ->[t] K2S + 3CO2 ^ + N2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ceea7a7123f7887d90e0cf99cef134ca1d8a504e)



![{\displaystyle {\ce {C + M_{x}O_{y}->[t] M + CO ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8cfa28be2f03e54bf1e95a7a14cf350a4714d172)
![{\displaystyle {\ce {3C + CaO ->[2500{°}C] CaC2 + CO ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/028643cf88a498e06c3de4ee7365290c18c5c318)
![{\displaystyle {\ce {4Al + 3C ->[t] Al4C3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6abb5d95fbe5b8f59fc04e48966e2c22cb7655b5)
![{\displaystyle {\ce {Ca + 2C ->[t] CaC2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba0f4ff07df41ba032cee9a29c95617e243c73fd)