Дерево — связный ациклический граф. Связность означает наличие маршрута между любой парой вершин, ацикличность — отсутствие циклов. Отсюда, в частности, следует, что число рёбер в дереве на единицу меньше числа вершин, а между любыми парами вершин имеется один и только один путь.

Транспортная РНК, тРНК — рибонуклеиновая кислота, обеспечивающая взаимодействие аминокислоты, рибосомы и матричной РНК (мРНК) в ходе трансляции. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм. тРНК, будучи ковалентно связаны с остатком аминокислоты, принимает непосредственное участие в наращивании полипептидной цепи, специфически присоединяясь к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса.

Гликозил-гидролазы катализируют гидролиз гликозидных связей в молекулах углеводов, приводя к появлению двух более мелких молекул углеводов. Эти ферменты встречаются в клетках почти всех живых организмов. Гликозидазы выполняют множество разнообразных функций: деградация биомассы, участие в антибактериальной защите организма, развитие патогенеза, клеточный биосинтез. Гликозидазы вместе с гликозилтрансферазами образуют основу биологического аппарата синтеза и разрушения гликозидных связей.

Аполипопротеин A2 — аполипопротеин плазмы крови, один из основных белков липопротеинов высокой плотности, носителя «хорошего холестерина».
Нейраминида́за — фермент, относящийся к гликозил-гидролазам. Номенклатурное название — экзо-α-сиалидаза. Также употребимы названия: α-нейраминидаза, N-ацилнейраминидатгликогидролаза, сиалидаза. Катализируемые реакции: гидролиз α-2→3-, α-2→6-, α-2→8-кетозидных связей концевых остатков сиаловой кислоты в олигосахаридах, гликопротеинах, гликолипидах и синтетических соединениях.
Cry-токсины — белковые токсины, продуцируемые бактерией Bacillus thuringiensis.
Вторичная структура — конформационное расположение главной цепи макромолекулы, независимо от конформации боковых цепей или отношения к другим сегментам. В описании вторичной структуры важным является определение водородных связей, которые стабилизируют отдельные фрагменты макромолекул.

Альфа-спираль (α-спираль) — типичный элемент вторичной структуры белков, который имеет форму правозакрученой винтовой линии и в котором каждая аминогруппа (-NH) в каркасе образует водородную связь с карбонильной группой (-C=O) аминокислоты, находящейся на 4 аминокислоты раньше. Этот элемент вторичной структуры иногда также называется классической альфа-спиралью Полинга — Кори — Брэнсона по именам авторов, впервые описавших эту структуру в 1951 году.

Т-клеточный рецептор — поверхностный белковый комплекс Т-лимфоцитов, ответственный за распознавание процессированных антигенов, связанных с молекулами главного комплекса гистосовместимости на поверхности антигенпредставляющих клеток. ТКР состоит из двух субъединиц, заякоренных в клеточной мембране, и ассоциирован с мультисубъединичным комплексом CD3. Взаимодействие ТКР с молекулами ГКГ и связанным с ними антигеном ведёт к активации Т-лимфоцитов и является ключевой точкой в запуске иммунного ответа.

Белки́ скользя́щего зажима, или скользя́щий зажи́м — белки, которые выполняют функцию усилителя процессивности при репликации ДНК.
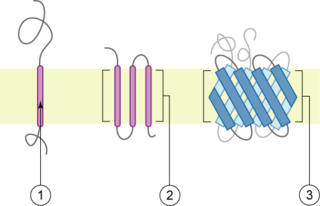
Трансмембранный белок — мембранный белок, который насквозь пронизывает липидный бислой, в котором он постоянно находится. Трансмембранные белки плотно закрепляются в мембране при помощи специального класса липидов, называемых кольцевая липидная оболочка. Многие из этих белков выполняют транспортную функцию, позволяя специфическим веществам пересекать биологическую мембрану, чтобы попасть внутрь клетки или же напротив, не давая им покинуть её пределов.

Третичная структура — пространственное строение всей молекулы белка или другой макромолекулы, состоящей из единственной цепи.

β-Лист — одна из форм регулярной вторичной структуры белков, немного более редкая, чем альфа-спираль. Бета-листы состоят из бета-цепей (нитей), связанных с боков двумя или тремя водородными связями, образуя слегка закрученные, складчатые листы.
Предсказа́ние структу́ры белка́ — направление молекулярного моделирования, предсказание по аминокислотной последовательности трёхмерной структуры белка. Данная задача является одной из самых важных целей биоинформатики и теоретической химии. Данные, полученные при помощи предсказания, применяются в медицине и биотехнологии при создании новых ферментов. Для лучших результатов сочетают несколько программ и методов.

Укладка Россманна — структурный мотив в третичной структуре белка, который связывает нуклеотиды. Структура, состоящая из двух идентичных частей, содержит шесть почти параллельных β-листов, соединённых между собой двумя парами α-спиралей, следующих в порядке β-α-β-α-β. Поскольку каждая укладка Россманна может связать один нуклеотид, связывающий домен для динуклеотидов, таких как НАД, состоит из двух параллельных укладок Россманна. Одиночная укладка Россманна может связать мононуклеотид, например, кофактор ФМН.
Ферредокси́ны — группа небольших растворимых белков, содержащих железосерные кластеры и являющихся подвижными переносчиками электронов в ряде метаболических процессов. Обычно они переносят один или два электрона за счёт изменения окисленности атомов железа.
Лакто́зный репре́ссор — ДНК-связывающий белок, который ингибирует экспрессию генов, кодирующих белки лактозного оперона. Кодируется геном lacI. Белки лактозного оперона участвуют в метаболизме лактозы в клетках бактерий. Эти гены подавляются, когда лактоза недоступна клеткам, гарантируя, что бактериальная клетка не будет тратить энергию на синтез белков, метаболизирующих лактозу, в условиях её отсутствия. Когда лактоза становится доступной, она преобразуется в аллолактозу, которая ингибирует способность лактозного репрессора связываться с ДНК. Когда репрессор не связан с оператором лактозного оперона, начинаются его транскрипция и последующий синтез ферментов метаболизма лактозы.

Электронпереносящий флавопротеин или ETF — флавопротеин, расположенный во внутренней митохондриальной мембране со стороны матрикса. Это специфический переносчик электронов, который получает их от различных дегидрогеназ. Он окисляется ETF-дегидрогеназой, которая передаёт электроны в дыхательную цепь переноса электронов. Электронпереносящий флавопротеины подразделяют на две группы в соответствии с их функциями: конститутивные или ETF «домашнего хозяйства», которые участвуют в окислении жирных кислот, и ETF, синтезируемые некоторыми прокариотами в определённых условиях для получения электронов от окисления определённых субстратов.

Бета-спираль — это тандемная структура повтора белка, образованная объединением параллельных бета-цепей в спиральном узоре с двумя или тремя гранями. Бета-спираль — это тип соленоидного белкового домена. Структура стабилизируется межцепочечными водородными связями, белок-белковыми взаимодействиями, а иногда и связанными ионами металлов. Идентифицированы как левозакрученная, так и правозакрученная бета-спирали. Двухцепочечные бета-спирали также являются очень частой особенностью белков и обычно синонимичны укладке «Желейного рулета»

Желейный рулет или швейцарский рулет — белковая укладка или сверхвторичная структура, состоящая из восьми бета-нитей, расположенных в двух четырёхнитевых листах. Название структуры, введённое Джейн С. Ричардсон в 1981 году, отражает его сходство с желейным или швейцарским пирогом. Укладка является продолжением мотива «Греческий ключ» и иногда считается формой бета-цилиндра. Она очень часто встречается в вирусных белках, особенно в вирусных капсидных белках. Взятые вместе, желейный рулет и греческий ключ составляют около 30 % всех бета-белков, аннотированных в базе данных структурной классификации белков (SCOP).













