Ферритин

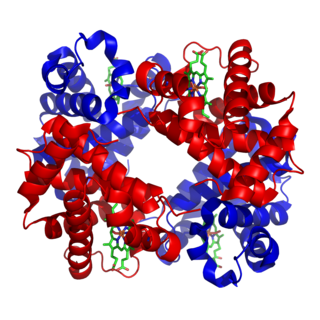
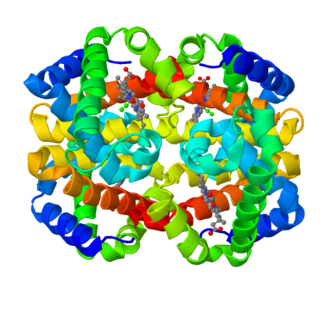
Феррити́н — сложный белковый комплекс (железопротеид), выполняющий роль основного внутриклеточного депо железа у человека и животных. Структурно состоит из белка апоферритина и атома трёхвалентного железа в составе фосфатного гидроксида. Одна молекула ферритина может содержать до 4000 атомов железа. Содержится практически во всех органах и тканях и является донором железа в клетках, которые в нём нуждаются[1].
В 2001 году учёным удалось открыть ферритин, который содержится в митохондриях (ген FTMT)[2].
В ситуации, когда железа начинает не хватать (частые кровопотери или нехватка его поступления вместе с пищей), организм человека начинает использовать его резерв из ткани. Уровень ферритина начинает снижаться. Длительная нехватка поступающего железа может привести к анемии. Уровень ферритина же бывает сниженным задолго до появления симптомов железодефицита и позволяет вовремя диагностировать анемию.
Наряду с этим снижается также уровень гемоглобина. Состояние сопровождается недостаточным снабжением кислородом клеток и тканей органов всего организма. В большей степени при этом страдает центральная и периферическая нервная система.
Нормы ферритина пересмотрены Американской гастроэнтерологической ассоциацией (AGA) в 2020 году, теперь этот показатель 45-120 нг/мл[3].
Структура
Ферритин является глобулярным белковым комплексом, состоящим из 24 субъединиц. У млекопитающих существуют два типа субъединиц, объединяющихся в ферритин, — H-субъединица содержащая ферроксидазный сайт, и L-субъединица, которая способствует обработке железа в этом сайте.
Ферритин неоднороден, известно до 20 изоферритинов, разнообразие которых обусловлено множеством факторов. В состав могут входить только H или L-субъединицы, либо HL одновременно. В сыворотке крови находится в основном HL ферритин, в печени и селезёнке L-ферритин.[1]
По способу происхождения различают два вида пигмента: «анаболический» — из железа, всасывающегося в кишечнике, и «катаболический» — из железа гемолизированных эритроцитов.
Важное значение имеет кислород: ферритин синтезируется из двухвалентного железа в присутствии кислорода и содержит много SS-групп. При гипоксии образуется SH-ферритин, обладающий вазопаралитическим действием.[1]
Строение ферритина растений: молекула ферритина состоит из центрального ядра, в котором располагается Fe, и окружающей его белковой оболочки (2-3 нм)[4]. Вновь образованный белок, лишенный Fe, называется апоферритин. Белковая оболочка, покрывающая ядро, состоит из 24 глобулярных субъединиц, каждая с молекулярной массой от 18,5 до 21 кД. В электронном микроскопе при общепринятом контрастировании срезов цитратом свинца оболочка электронно-прозрачна и становится видимой только при негативном окрашивании. Молекулярная масса нативного апоферритина варьирует от 480 до 510 кДа.[5] При образовании апоферритина субъединицы формируют центральную полость (диаметром 5-8 нм), которая в последующем загружается ионами Fe2+.[6] Это железо концентрируется и кристаллизуется в гидроксид Fe3+, образующего минеральное ядро. В ядре каждый атом Fe3+ окружён приблизительно шестью атомами кислорода.[7]
Физиология
Ферритин является важным железосвязывающим протеином, и его главная функция — создание в организме запасов железа. Известно, что свободные атомы железа токсичны для организма. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме. Обычный уровень растворимости железа низок: 10−18 M, ферритин увеличивает его до 10−4 M, что в 100 триллионов раз выше[8].
Именно в форме ферритина депонируется железо (до 30 %, хотя расходуется только 0,1 %), которое при необходимости расходуется на нужды организма. Также ферритин осуществляет перенос железа в кишечнике и плаценте, то есть является медиатором при соединении железа с трансферрином и в переносе его от матери к плоду.[1]
Однако ферритин сыворотки является также острофазовым регулирующим протеином, концентрация которого увеличивается в ответ на инфекции в организме.
Ферритин обладает способностью связывать железо, присутствие которого в клетке инициирует и катализирует свободнорадикальные процессы, в том числе перекисное окисление липидов биомембран, и обладает ярко выраженным антирадикальным эффектом, реализующимся разными способами (кроме способности связывать свободное железо Fe2+, Fe3+, он снижает уровень ОН).[9]
Клиническое значение
Ферритин используется в качестве показателя запасов железа в организме, а также для дифференциальной диагностики железодефицитных анемий и анемий при хронических заболеваниях. Снижение уровня сывороточного ферритина говорит об истинном дефиците железа (железодефицитная анемия), в то время как перераспределительный дефицит железа, сопутствующий хроническим заболеваниям, сопровождается повышением уровня ферритина в крови. Это важно учитывать при назначении препаратов железа, поскольку при перераспределительном дефиците они могут привести к вторичному гемосидерозу и усугубить состояние больного.
Мутации гена FTL, кодирующего лёгкую цепь ферритина человека, вызывают «взрослую болезнь базальных ганглиев» (OMIM 606159) с альтернативным названием «нейроферритинопатия»,[10] а также «синдром гиперферритинемии с катарактой» (OMIM 600886).
Стоит отметить, что использование разных анализов, отражающих обмен железа в организме, дает более полную и достоверную информацию о недостатке или переизбытке этого микроэлемента, чем только тест на ферритин.
Подготовка к анализу
Рекомендации, которые следует соблюдать для получения максимально точных результатов исследования:
- биоматериал сдается строго натощак, последний приём пищи должен происходить минимум за 8 часов до венепункции;
- важно пить чистую и несладкую воду. Это существенно облегчит процедуру взятия биоматериала и снизит риск возникновения гемолиза (разрушения эритроцитов в пробирке). Любые нарушения правил взятия и хранения биоматериала — повод для обязательной отмены проведения анализа;
- необходимо исключить на 3 суток приём любых лекарственных средств, в составе которых присутствует железо. Перед отменой следует проконсультироваться с лечащим врачом;
- за 30-40 минут до взятия биоматериала пациенту следует избегать физического и эмоционального напряжения. Поскольку стрессы стимулируют работу эндокринной системы и влияют на биохимический состав исследуемого биоматериала.
Определения уровня рассматриваемого критерия недостаточно для полного понимания количества железа в крови. Исследование назначается в комплексе с другими лабораторными анализами.[11]
Методы определения
Лабораторная диагностика проводится с помощью сульфата кадмия по методу Клочкова, а также иммуногистохимическими методами с использованием специфических антисывороток. На практике чаще используется гистохимический метод — реакция образования берлинской лазури (железосинеродистое железо) или реакции Перльса, на выявление солей оксида железа (III) с помощью железосинеродистого калия и соляной кислоты.[1]
Референсные показатели
Максимальное содержание белка наблюдается у новорожденных. Так, уровень ферритина в крови в первые 2 месяца достигает 600 мкг/л.
Затем его величина постепенно снижается. В возрасте от 2 месяцев до полугода нормальные величины находятся в интервале от 55 до 210 мкг/л.
После полугода показатель достаточно стабилен до 15 лет. Его величина в норме варьирует от 8 до 143 мкг/л.
После наступления пубертатного периода у юноши референсные значения составляют: 21 — 250 мкг/л.
В норме содержание ферритина у женщин несколько ниже, чем у мужчин. Так, до 15 лет норма составляет от 7 до 120 мкг/л. Нормальные значения для девушек старше 15 лет от 10 до 125 мкг/л.[11]
Согласно информации акушерского гематологического центра, норма ферритина при беременности:
- на 1 м триместре — порядка 50 % от нормы не беременной женщины;
- на 2 м триместре — порядка 30 %;
- и на 3 м триместре — не менее 12 %.
Заболевания
Приводящие к повышению уровня ферритина в крови:
- Наследственный гемохроматоз. При этом заболевании из пищи всасывается слишком много железа, которое откладывается в различных органах, вызывая их повреждение.
- Множественные переливания крови, введение железа внутримышечно, назначение таблетированных препаратов железа.
- Воспаления, например инфекции верхних дыхательных путей, мочевыводящих путей, аутоиммунные заболевания. Причем повышение ферритина в острой фазе воспаления может маскировать имеющийся дефицит железа.
- Острые или хронические заболевания печени.
- Алкоголизм.
- Гемолитические анемии: связанные с разрушением эритроцитов, B12-дефицитная анемия, талассемия.
- Гипертиреоз — повышение функции щитовидной железы.
- Онкологические заболевания костного мозга, рак молочной железы, болезнь Ходжкина — злокачественное новообразование лимфоидной ткани. Уровень ферритина при этом будет повышен значительно.
Приводящие к снижению уровня ферритина в крови:
- Дефицит железа, в том числе скрытый. Снижение ферритина ниже 45 нг/мл, как правило, говорит о железодефицитной анемии.
- Третий триместр беременности. Уменьшение количества железа в таком случае является нормальным
Диета
При диагностировании недостаточного уровня ферритина в крови врачи рекомендуют включить в рацион следующие продукты:
- печень и иные субпродукты;
- гречка, овсянка, рис;
- смородина черная, вишня;
- миндаль, грецкие орехи;
- куриные яйца;
- томаты, свекла;
- бобовые культуры;
- шпинат, любая свежая зелень;
- гранаты, яблоки;
- морепродукты (устрицы, креветки);
- мясо (телятина или говядина)[12].
Примечания
- ↑ 1 2 3 4 5 Патологическая анатомия : Курс лекций / под ред. В. В. Серова, М. А. Пальцева. — М. : Медицина, 1998. — С. 58. — ISBN 5-225-02779-2.
- ↑ Levi, S.; Corsi, B.; Bosisio, M.; Invernizzi, R.; Volz, A.; Sanford, D.; Arosio, P.; Drysdale, J. : A human mitochondrial ferritin encoded by an intronless gene. J. Biol. Chem. 276: 24437-24440, 2001. PMID 11323407
- ↑ Ko CW, Siddique SM, Patel A, et al. AGA clinical practice guidelines on the gastrointestinal evaluation of iron deficiency anemia [published online August 15, 2020]. Gastroenterology. doi: 10.1053/j.gastro.2020.06.046
- ↑ Seckbach J. Ferriting Out the Secrets of Plant Ferritin – a Review // J. Plant Nutr.. — 1985. — Т. V. 5. — С. 369–394.
- ↑ Theil E. C. Ferritin: Structure, Gene Regulation, and Cellular Function in Animals, Plants and Microorganisms // Ann. Rev. Biochem. — 1987. — Т. V. 56. — С. P. 289–315..
- ↑ Laulhere J. P., Laboure A.-M., Briat J.-F. Mechanism of the Transition from Plant Ferritin to Phytosiderin // J. Biol. Chem. — 1989. — Т. V. 264. — С. P. 3629–3635..
- ↑ Андреев Г. И. Ферритин как маркер железодефицитной анемии и опухолевый маркер // Интернет-журнал Коммерческая биотехнология. — 2004.
- ↑ Ferritin: at the crossroads of iron and oxygen metabolism Архивная копия от 4 апреля 2009 на Wayback Machine. Theil EC. J Nutr. 2003 May;133(5 Suppl 1):1549S-53S. Review. PMID 12730463
- ↑ Сумная Д.Б. Ферритин в остром периоде черепно-мозговой травмы (рус.) // ИЗВЕСТИЯ ЧЕЛЯБИНСКОГО НАУЧНОГО ЦЕНТРА УРО РАН. — ИЗВЕСТИЯ ЧЕЛЯБИНСКОГО НАУЧНОГО ЦЕНТРА УРО РАН.
- ↑ Curtis, A. R. J.; Fey, C.; Morris, C. M.; Bindoff, L. A.; Ince, P. G.; Chinnery, P. F.; Coulthard, A.; Jackson, M. J.; Jackson, A. P.; McHale, D. P.; Hay, D.; Barker, W. A.; Markham, A. F.; Bates, D.; Curtis, A.; Burn, J. : Mutation in the gene encoding ferritin light polypeptide causes dominant adult-onset basal ganglia disease. Nature Genet. 28: 350—354, 2001. PMID 11438811
- ↑ 1 2 Значение и норма ферритина в крови. Дата обращения: 28 января 2019. Архивировано 29 января 2019 года.
- ↑ Большая медицинская энциклопедия / под ред. Б. В. Петровского. — 3-е изд.
Литература
- Розанова Л. С. Исследование гипотензивных свойств железа в условиях экспериментальной почечной гипертонии : К вопросу о роли ферритина : диссертация … кандидата биологических наук : 03.00.00. — М. : [б. и.], 1958. — 222 с. : ил.