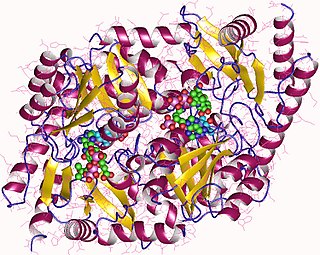
Феррохелатаза
| Феррохелатаза | |
|---|---|
 димер феррохелатазы, человек | |
| Идентификаторы | |
| Шифр КФ | 4.98.1.1 |
| Номер CAS | 9012-93-5 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9012-93-5 |
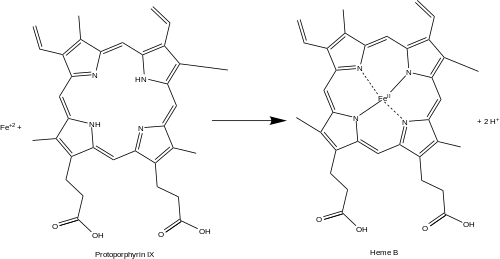
Феррохелатаза, также протопорфирин феррохелатаза или протогем ферро-лиаза (протопорфиринобразующая) — фермент (КФ 4.98.1.1 ) из класса лиаз, который катализирует последнюю (8-ю) реакцию биосинтеза гема — превращение молекул протопорфирина IX в гем Б. У человека фермент кодируется геном FECH, локализованный на коротком плече (p-плече) 18-й хромосомы[1]. Реакция, катализируемая данным ферментом:
- протогем (гем Б) + 2H+ = протопорфирин IX + Fe+2.
Феррохелатаза обнаруживается в больших количествах в митохондриях эритропоэтических клеток (проэритробластах, эритробластах, ретикулоцитах) и гепатоцитах печени.
Структура
Феррохелатаза человека представляет собой гомодимер, состоящий из двух полипептидных цепей, включающие 359 аминокислотных остатков. Его общая молекулярная масса составляет 85,07 кДа[2]. Каждая субъединица состоит из пяти областей: последовательности митохондриальной локализации, N-концевого домена, двух складчатых доменов и С-концевого удлинения. Остатки 1-62 образуют домен митохондриальной локализации, который расщепляется в посттрансляционной модификации. Свёрнутые домены содержат в общей сложности 17 α-спиралей и 8 β-листов. С-концевое удлинение содержит три из четырёх цистеиновых остатков (Cys-403, Cys-406, Cys-411), которые координируют каталитический железосерный кластер (2Fe-2S). Четвёртый координирующий цистеин находится в N-концевом домене (Cys-196)[3].
Активный карман феррохелтазы состоит из двух гидрофобных «губ» и гидрофильной внутренней части. Гидрофобные «губы», состоящие из высококонсервативных остатков 300-311, обращены к внутренней митохондриальной мембране и облегчают прохождение через мембрану малорастворимого субстрата протопорфирина IX и продукта гема. Внутренняя часть кармана активного центра содержит высококонсервативную кислую поверхность, которая облегчает извлечение протонов из протопорфирина. Остатки гистидина и аспартата примерно в 20 ангстремах (2 нм) от центра активного центра на стороне митохондриального матрикса фермента координируют связывание ионов металлов[3].
Механизм катализа
Механизм металлирования (связывание ионов железа) протопорфирина человека остаётся в стадии изучения. Многие исследователи выдвинули гипотезу о том, что искажение макроцикла порфирина является ключом к катализу. Исследователи, изучающие феррохелатазу Bacillus subtilis, предлагают механизм введения железа в протопорфирин, при котором фермент плотно захватывает кольца B, C и D, изгибая кольцо A на 36°. Обычно кольцо А плоское и данное искажение подвергает неподелённую пару электронов азота в кольце A мигрировать к иону Fe2+[4]. Последующее исследование выявило искажение на 100° в протопорфирине, связанное с феррохелатазой человека. Высококонсервативный остаток гистидина (His-183 у B. subtilis, His-263 у человека) необходим для определения типа искажения, а также действует как исходный акцептор протона из протопорфирина[3][5]. Анионные остатки образуют путь, облегчающий отвод протонов от каталитического гистидина[3]. Фратаксин связывает железо с матриксной стороны феррохелатазы, где остатки аспартата и гистидина в обоих белках координируют перенос железа в феррохелатазу[6]. Два остатка аргинина и тирозина в активном центре (Arg-164, Tyr-165) могут осуществлять окончательное металлирование[3].
Функции
В процессе биосинтеза гема феррохелатаза катализирует встраивание двухвалентного железа (Fe2+) в протопорфирин IX с образованием гема Б. Фермент локализован на обращённой к матриксу стороне внутренней митохондриальной мембраны. Феррохелатаза является наиболее известным представителем семейства ферментов, которые добавляют катионы двухвалентных металлов к тетрапиррольным структурам[4]. Например, хелатаза магния добавляет магний к протопорфирину IX на первой стадии биосинтеза бактериохлорофилла[7].
Гем Б является важной простетической группой многих белков и ферментов. В частности, гем Б играет ключевую роль в качестве переносчика кислорода в гемоглобине в эритроцитах и миоглобине в мышечных клетках. Кроме того, гем Б обнаружен в цитохроме b, ключевом компоненте убихинол-цитохром с оксидоредуктазы (комплекс III) окислительного фосфорилирования[8].
Клиническое значение
Дефекты феррохелатазы создают накопление протопорфирина IX, вызывая заболевание эритропоэтическую протопорфирию (ЭПП)[9]. Заболевание может быть результатом различных мутаций гена FECH, большинство из которых носят аутосомно-доминантный характер с низкой клинической пенетрантностью. Клинически у пациентов с ЭПП проявляется ряд симптомов, от бессимптомных до крайне болезненной светочувствительности. Менее чем в пяти процентах случаев накопление протопорфирина в печени приводит к холестазу (блокировке оттока жёлчи из печени в тонкую кишку) и терминальной печёночной недостаточности[10].
В случаях отравления свинцом происходит ингибирование активности феррохелатазы, что частично приводит к порфирии[11].
Взаимодействия
Феррохелатаза взаимодействует со многими другими ферментами, участвующими в биосинтезе, катаболизме и транспорте гема, включая протопорфириногеноксидазу, АЛК-синтазу, ABCB10, ABCB7, сукцинил-КоА-синтетазу[12] и митоферрин-1[13]. Многочисленные исследования показали существование олигомерного комплекса, который обеспечивает передачу субстрата и координацию общего метаболизма железа и порфирина по всей клетке[12][13]. N-метилмезопорфирин (N-MeMP) является конкурентным ингибитором протопорфирина IX и считается аналогом переходного состояния. Таким образом, N-MeMP широко используется в качестве стабилизирующего лиганда для определения структуры с помощью рентгеновской кристаллографии[14]. Фратаксин действует как шаперон Fe2+ и образует комплексы с феррохелатазой на стороне митохондриального матрикса[6]. Феррохелатаза также может вставлять ионы других двухвалентных металлов в протопорфирин. Некоторые ионы, такие как Zn2+, Ni2+ и Co2+, образуют другие металлопорфирины, в то время как ионы более тяжёлых металлов, такие как Mn2+, Pb2+, Hg2+ и Cd2+, препятствуют высвобождению продукта после металлирования[15].
См. также
Примечания
- ↑ FECH - Ferrochelatase, mitochondrial precursor - Homo sapiens (Human) - FECH gene & protein. Дата обращения: 28 апреля 2023. Архивировано 8 июня 2019 года.
- ↑ RCSB PDB - 1Hrk: Crystal Structure of Human Ferrochelatase. Дата обращения: 28 апреля 2023. Архивировано 6 июля 2017 года.
- ↑ 1 2 3 4 5 Wu, Chia-Kuei; Dailey, Harry A.; Rose, John P.; Burden, Amy; Sellers, Vera M.; Wang, Bi-Cheng (1 February 2001). "The 2.0 Å structure of human ferrochelatase, the terminal enzyme of heme biosynthesis". Nature Structural Biology. 8 (2): 156—160. doi:10.1038/84152. PMID 11175906. S2CID 9822420.
- ↑ 1 2 Lecerof, D.; Fodje, M.; Hansson, A.; Hansson, M.; Al-Karadaghi, S. (March 2000). "Structural and mechanistic basis of porphyrin metallation by ferrochelatase". Journal of Molecular Biology. 297 (1): 221—232. doi:10.1006/jmbi.2000.3569. PMID 10704318.
- ↑ Karlberg, Tobias; Hansson, Mattias D.; Yengo, Raymond K.; Johansson, Renzo; Thorvaldsen, Hege O.; Ferreira, Gloria C.; Hansson, Mats; Al-Karadaghi, Salam (May 2008). "Porphyrin Binding and Distortion and Substrate Specificity in the Ferrochelatase Reaction: The Role of Active Site Residues". Journal of Molecular Biology. 378 (5): 1074—1083. doi:10.1016/j.jmb.2008.03.040. PMC 2852141. PMID 18423489.
- ↑ 1 2 Bencze, Krisztina Z.; Yoon, Taejin; Mill?n-Pacheco, C?sar; Bradley, Patrick B.; Pastor, Nina; Cowan, J. A.; Stemmler, Timothy L. (2007). "Human frataxin: iron and ferrochelatase binding surface". Chemical Communications (18): 1798—1800. doi:10.1039/B703195E. PMC 2862461. PMID 17476391. Архивировано 13 августа 2023. Дата обращения: 28 апреля 2023.
- ↑ Leeper, F. J. (1985). "The biosynthesis of porphyrins, chlorophylls, and vitamin B12". Natural Product Reports. 2 (1): 19—47. doi:10.1039/NP9850200019. PMID 3895052.
- ↑ Berg, Jeremy. Biochemistry / Jeremy Berg, John Tymoczko, Lubert Stryer. — 7th. — New York : W.H. Freeman, 2012. — ISBN 9781429229364.
- ↑ James, William D. Andrews' Diseases of the Skin: clinical Dermatology / William D. James, Timothy G. Berger. — Saunders Elsevier, 2006. — ISBN 0-7216-2921-0.
- ↑ Rüfenacht, U.B.; Gouya, L.; Schneider-Yin, X.; Puy, H.; Schäfer, B.W.; Aquaron, R.; Nordmann, Y.; Minder, E.I.; Deybach, J.C. (1998). "Systematic Analysis of Molecular Defects in the Ferrochelatase Gene from Patients with Erythropoietic Protoporphyria". The American Journal of Human Genetics. 62 (6): 1341—52. doi:10.1086/301870. PMC 1377149. PMID 9585598.
- ↑ Lead Toxicity -- What Are Possible Health Effects from Lead Exposure? Agency for Toxic Substances & Disease Registry. Дата обращения: 9 февраля 2021. Архивировано 24 января 2021 года.
- ↑ 1 2 Medlock, Amy E.; Shiferaw, Mesafint T.; Marcero, Jason R.; Vashisht, Ajay A.; Wohlschlegel, James A.; Phillips, John D.; Dailey, Harry A.; Liesa, Marc (19 August 2015). "Identification of the Mitochondrial Heme Metabolism Complex". PLOS ONE. 10 (8): e0135896. Bibcode:2015PLoSO..1035896M. doi:10.1371/journal.pone.0135896. PMC 4545792. PMID 26287972.
- ↑ 1 2 Chen, W.; Dailey, H. A.; Paw, B. H. (28 April 2010). "Ferrochelatase forms an oligomeric complex with mitoferrin-1 and Abcb10 for erythroid heme biosynthesis". Blood. 116 (4): 628—630. doi:10.1182/blood-2009-12-259614. PMC 3324294. PMID 20427704.
- ↑ Medlock, A.; Swartz, L.; Dailey, T. A.; Dailey, H. A.; Lanzilotta, W. N. (29 January 2007). "Substrate interactions with human ferrochelatase". Proceedings of the National Academy of Sciences. 104 (6): 1789—1793. Bibcode:2007PNAS..104.1789M. doi:10.1073/pnas.0606144104. PMC 1794275. PMID 17261801.
- ↑ Medlock, Amy E.; Carter, Michael; Dailey, Tamara A.; Dailey, Harry A.; Lanzilotta, William N. (October 2009). "Product Release Rather than Chelation Determines Metal Specificity for Ferrochelatase". Journal of Molecular Biology. 393 (2): 308—319. doi:10.1016/j.jmb.2009.08.042. PMC 2771925. PMID 19703464.