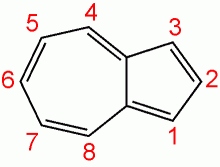
Флуорантен
| Флуорантен | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Флуорантен |
| Хим. формула | C16H10 |
| Физические свойства | |
| Молярная масса | 202,26 г/моль |
| Плотность | 1,252 г/см³ |
| Энергия ионизации | 7,95 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | 110,4-111,4 °C |
| • кипения | 382-383 °C |
| Классификация | |
| Рег. номер CAS | 206-44-0 |
| PubChem | 9154 |
| Рег. номер EINECS | 205-912-4 |
| SMILES | |
| InChI | |
| ChEBI | 33083 |
| ChemSpider | 8800 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Флуорантен — полициклический ароматический углеводород.
Свойства
Флуорантен представляет собой бесцветные кристаллы, легко растворимые в диэтиловом эфире и горячем этаноле и нерастворимые в воде.
Флуорантен способен гидрироваться: действием натрия в этаноле образуется 1,2,3,10b-тетрагидрофлуорантен, а при гидрировании на никелевом катализаторе — пергидрофлуорантен.
Окисление флуорантена сильными окислителями (например, хромовой кислоты) ведёт сначала к флуорантен-2,3-хинону, а при дальнейшем окислении — к разрыву C-C связи и образованию 9-флуоренон-1-карбоновой кислоты.
Флуорантен способен также вступать в реакции электрофильного замещения, при этом замещение идёт в положения 3 и 8, затем — в положение 9.
Получение и применение
Флуорантен в количествах 2,0—3,5 % обнаруживается во фракции «антраценового масла» в каменноугольной смоле, откуда его выделяют и очищают перекристаллизацией. Его также получают синтезируют из 1-иоднафталина и 2-бромнитрофенола.
Флуорантен используется в синтезе флуоресцентных красителей. Для синтеза некоторых лекарственных средств используются тетрагидропроизводные флуорантена.
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.
Примечания
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5