Фруктозо-1,6-бисфосфатаза
| Фруктозо-1,6-бисфосфатаза | |
|---|---|
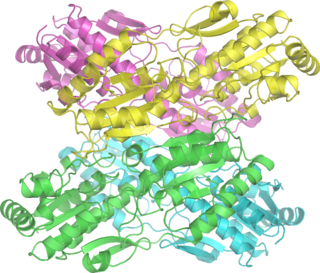
 Кристаллическая структура фруктозы-1,6-бисфосфатазы печени кролика. Разрешение 2,3 ангстрем. | |
| Идентификаторы | |
| Символ | FBPase |
| Pfam | PF00316 |
| Pfam clan | CL0171 |
| InterPro | IPR000146 |
| PROSITE | PDOC00114 |
| SCOP | 1frp |
| SUPERFAMILY | 1frp |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
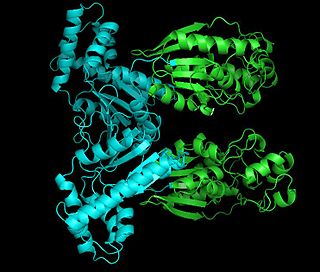
| Фруктозо-1,6-бисфосфатаза в твёрдом состоянии | |
|---|---|
 | |
| Идентификаторы | |
| Символ | FBPase_2 |
| Pfam | PF06874 |
| Pfam clan | CL0163 |
| InterPro | IPR009164 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| Фруктозо-1,6-бисфосфатаза | |
|---|---|
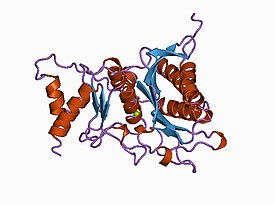
 Кристаллическая структура фруктозо-1,6-бисфосфатазы | |
| Идентификаторы | |
| Символ | FBPase_3 |
| Pfam | PF01950 |
| InterPro | IPR002803 |
| SCOP | 1umg |
| SUPERFAMILY | 1umg |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Фруктозо-1,6-бисфосфатаза, также Фруктозо-1,6-дисфосфатаза (ФБФ-аза, FBP сокр. от англ. Fructose 1,6-bisphosphatase, шифр КФ 3.1.3.11) — фермент из группы фосфатаз (класс гидролазы), катализирующий реакцию гидролиза фруктозо-1,6-бисфосфата до фруктозо-6-фосфата с образованием неорганического фосфата по реакции:
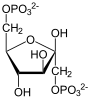 + H2O
+ H2O 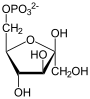 + Pi
+ Pi
Данная реакция протекает в глюконеогенезе и цикле Кальвина, которые относят к анаболическими процессами. Фруктозо-1,6-бисфосфатаза катализирует обратную реакцию, по отношению к реакции, катализируемой фосфофруктокиназой в процессе гликолиза[1][2]. Эти ферменты катализируют реакции только в одном направлении, и регулируются метаболитами, такими как фруктозо-2,6-бисфосфат, так что высокая активность одного из двух ферментов сопровождается низкой активностью другого. Известно, что фруктозо-2,6-бисфосфат способен также аллостерически связываться с фруктозо-1,6-бисфосфатазой, тем самым ингибируя её, но активирует при этом фосфофруктокиназу. ФБФ-аза участвует в различных метаболических путях и встречается у большинства организмов. ФБФ-азе для катализа в качестве кофакторов требуются ионы двухвалентных металлов (предпочтительнее Мg2+ и Мn2+), при этом ионы лития Li+ являются мощными ингибиторами.
Ген, кодирующий данные фермент — FBP1, локализован на 9-й хромосоме.
Структура
Было отмечено, что фолд фруктозо-1,6-бисфосфатазы свиньи идентичен инозитол-1-фосфатазе (ИМФ-азе)[3]. Инозитолполифосфат 1-фосфатаза (ИПФ-аза), ИМФ-аза и ФБФ-аза имеют мотив последовательности (Asp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Ser), который, как было показано, связывает ионы металлов и участвует в катализе. Этот мотив также встречается в дистанционно связанных грибковых, бактериальных и дрожжевых гомологах ИМФ-азы. Было высказано предположение, что эти белки определяют древнее структурно-консервативное семейство, вовлечённое в различные метаболические пути, включая сигнализацию инозитолом, глюконеогенез, усвоение сульфата и, возможно, метаболизм хинона[4].
Распределение видов
Три различные группы фруктозо-1,6-бисфосфатазы были идентифицированы у эукариот и бактерий (ФБФ-азы I—III)[5]. Ни одна из этих групп до сих пор не была найдена в археях, однако, новая группа ФБФ-аз (ФБФ-азы IV), которая также проявляет свойства инозитол монофосфатазы, недавно выявлена у архей[6].
Новая группа ФБФ-аз (ФБФ-азы V) встречается в термофильных археях и гипертермофильных бактериях Aquifex aeolicus[7].
Участие в лечении диабета
Фруктозо-1,6-бисфосфатаза также играет ключевую роль в лечении сахарного диабета 2 типа. Это заболевание характеризуется гипергликемией (повышенной концентрацией глюкозы в крови), которая вызывает множество серьёзных проблем, и в лечении часто приходится акцентировать внимание на снижение уровня сахара в крови[8][9][10]. Усиленный глюконеогенез в печени является одной из основных причин перепродукции глюкозы у этих больных, и поэтому ингибирование глюконеогенеза является разумным способом для лечения сахарного диабета 2 типа.
Дефицит
Мутации в гене FBP1 могут приводить к наследственной недостаточности фруктозо-1,6-бисфосфатазы. Это аутосомно-рецессивное заболевание, характеризующееся нарушениям процесса глюконеогенеза, которые приводят к гипогликемии, лактатацидозу, гипервентиляции, судорогам и гипогликемической коме. Особенно опасны эти проявления среди новорождённых, так как среди них наблюдается высокая летальность.
Примечания
- ↑ Marcus F., Harrsch P.B. Amino acid sequence of spinach chloroplast fructose-1,6-bisphosphatase (англ.) // Archives of Biochemistry and Biophysics[англ.] : journal. — Elsevier, 1990. — May (vol. 279, no. 1). — P. 151—157. — doi:10.1016/0003-9861(90)90475-E. — PMID 2159755.
- ↑ Marcus F., Gontero B., Harrsch P.B., Rittenhouse J. Amino acid sequence homology among fructose-1,6-bisphosphatases (англ.) // Biochemical and Biophysical Research Communications[англ.] : journal. — 1986. — March (vol. 135, no. 2). — P. 374—381. — doi:10.1016/0006-291X(86)90005-7. — PMID 3008716.
- ↑ Zhang Y., Liang J.Y., Lipscomb W.N. Structural similarities between fructose-1,6-bisphosphatase and inositol monophosphatase (англ.) // Biochemical and Biophysical Research Communications[англ.] : journal. — 1993. — February (vol. 190, no. 3). — P. 1080—1083. — doi:10.1006/bbrc.1993.1159. — PMID 8382485.
- ↑ York J.D., Ponder J.W., Majerus P.W. Definition of a metal-dependent/Li(+)-inhibited phosphomonoesterase protein family based upon a conserved three-dimensional core structure (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1995. — May (vol. 92, no. 11). — P. 5149—5153. — doi:10.1073/pnas.92.11.5149. — PMID 7761465. — PMC 41866.
- ↑ Donahue J.L., Bownas J.L., Niehaus W.G., Larson T.J. Purification and characterization of glpX-encoded fructose 1, 6-bisphosphatase, a new enzyme of the glycerol 3-phosphate regulon of Escherichia coli (англ.) // Journal of Bacteriology[англ.] : journal. — 2000. — October (vol. 182, no. 19). — P. 5624—5627. — doi:10.1128/jb.182.19.5624-5627.2000. — PMID 10986273. — PMC 111013.
- ↑ Stec B., Yang H., Johnson K.A., Chen L., Roberts M.F. MJ0109 is an enzyme that is both an inositol monophosphatase and the 'missing' archaeal fructose-1,6-bisphosphatase (англ.) // Nature Structural Biology : journal. — 2000. — November (vol. 7, no. 11). — P. 1046—1050. — doi:10.1038/80968. — PMID 11062561.
- ↑ Rashid N., Imanaka H., Kanai T., Fukui T., Atomi H., Imanaka T. A novel candidate for the true fructose-1,6-bisphosphatase in archaea (англ.) // The Journal of Biological Chemistry : journal. — 2002. — August (vol. 277, no. 34). — P. 30649—30655. — doi:10.1074/jbc.M202868200. — PMID 12065581.
- ↑ Dang* Qun, Van Poelje Paul D., Erion Mark D. Chapter 11. The Discovery and Development of MB07803, a Second-Generation Fructose-1,6-bisphosphatase Inhibitor with Improved Pharmacokinetic Properties, as a Potential Treatment of Type 2 Diabetes (англ.) // Drug Discovery. — 2012. — P. 306—323. — ISBN 9781849734141. — ISSN 2041-3211. — doi:10.1039/9781849735322-00306.
- ↑ Hofmann, F.B. and Munchen. «Handbook of experimental pharmacology: Diabetes — perspectives in drug therapy.» Springer-Verlag Berlin Heidelverg 203 (2011). Web.
- ↑ van Poelje P. D., Potter S. C., Chandramouli V. C., Landau B. R., Dang Q., Erion M. D. Inhibition of fructose 1,6-bisphosphatase reduces excessive endogenous glucose production and attenuates hyperglycemia in Zucker diabetic fatty rats. (англ.) // Diabetes. — 2006. — June (vol. 55, no. 6). — P. 1747—1754. — doi:10.2337/db05-1443. — PMID 16731838.