Фторид аммония
| Фторид аммония | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Фторид аммония | ||
| Традиционные названия | Фтористый аммоний | ||
| Хим. формула | NH4F | ||
| Физические свойства | |||
| Состояние | бесцветные кристаллы | ||
| Молярная масса | 37,037 г/моль | ||
| Плотность | 1,002; 1,009 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | разл. 167 °C | ||
| Мол. теплоёмк. | 65,27 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -465,9 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 82,620; 117,680 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 12125-01-8 | ||
| PubChem | 25516 и 16211145 | ||
| Рег. номер EINECS | 235-185-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | BQ6300000 | ||
| ChEBI | 66871 | ||
| Номер ООН | 2505 | ||
| ChemSpider | 23806 | ||
| Безопасность | |||
| Токсичность | весьма ядовит, ПДК 0,5 мг/м³ | ||
| Пиктограммы ECB | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фторид аммония — неорганическое соединение, соль аммония и фтористоводородной кислоты с формулой NH4F, бесцветные кристаллы, растворимые в воде, образует кристаллогидрат, ядовит.
Получение
Растворение аммиака в плавиковой кислоте:
Взаимодействие аммиака и гидрофторида аммония:
Разложение карбоната аммония плавиковой кислотой:
Гидролиз аммиаком гексафторсиликата аммония:
Нагреванием смеси твёрдых хлорида аммония и избытка фторида натрия в платиновом тигле с последующей конденсацией фторида аммония[1][2]. В некоторых источниках рекомендуют смешивать 1 часть хлорида аммония с 2.25 частями фторида натрия[1], что превышает необходимое стехиометрически количество в 2.87 раз:
Физические свойства
Фторид аммония образует бесцветные гигроскопичные кристаллы гексагональной сингонии, пространственная группа P 6mc, параметры ячейки a = 0,4439 нм, c = 0,7165 нм, Z = 2. Такая структура близка к кристаллической структуре водяного льда, и фторид аммония является единственным веществом, способным формировать совместные кристаллы с водой[3].
Хорошо растворяется в воде, из раствора при −27,4°С выделяется кристаллогидрат NH4F•H2O. Растворяется в метаноле, несколько хуже — в этаноле.
Водные растворы имеют слабокислую реакцию из-за гидролиза по катиону.
Химические свойства
В водном растворе диссоциирует с гидролизом и по аниону, и по катиону (гидролиз по катиону выраженно преобладает):
Может вступать в реакции ионного обмена:
При нагревании твёрдого вещества (а равно при кипячении водного раствора) разлагается:
Фторид ион может быть протонирован в очень сильнокислой среде (процесс происходит неохотно и преимущественно при нагревании):
Также, ион аммония может быть замещён щелочами:
С концентрированной плавиковой кислотой образует гидрофторид аммония[4]:
Водные растворы способны реагировать с оксидом кремния (IV)[2], ввиду чего разрушают стекло[1]:
Помимо этого, фторид аммония также способен реагировать с гидроксидами галлия и алюминия[2]:
Способен реагировать с некоторыми соединениями фосфора(V), образуя гексафторфосфат(V) аммония[2]:
Применение
- Фторирующий агент.
- Компонент растворов для очистки котлов и труб.
- Компонент составов для травления полупроводников, стекла и некоторых металлов.
Примечания
- ↑ 1 2 3 Georg Brauer. Handbook of Preparative Inorganic Chemistry, vol. 1, second ed. (англ.). — New York: ACADEMIC PRESS INC., 1963. — 183 p.
- ↑ 1 2 3 4 Pradyot Patnaik. Handbook of Inorganic Chemistry (англ.). — P. 36.
- ↑ Brill, R.; Zaromb, S. Mixed Crystals of Ice and Ammonium Fluoride (англ.) // Nature. — Vol. 173, no. 4398. — P. 316—317. — doi:10.1038/173316a0.
- ↑ Лидин, 2000, с. 143.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
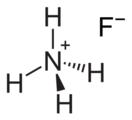


![{\displaystyle {\ce {NH3 + NH4[HF2] -> 2NH4F}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4237499415c80827276848ec84672bf22b41b33c)





![{\displaystyle {\ce {2NH4F_{(s)}->[>168^{o}C] NH4[HF2] + NH3 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a8fe46e6b056539707e12ad49bd377d6c5dcea61)
![{\displaystyle {\ce {2NH4F_{(aq)}->[{вода, кип.}] NH4[HF2] + NH3 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43441b96c28f072d08fd2c9f122bd5efe892b8af)
![{\displaystyle {\ce {NH4F + H2SO4 ->[t] NH4HSO4 + HF ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/808ea5806449190fef0d431dbe35b600207716f0)


![{\displaystyle {\ce {NH4F + HF -> NH4[HF2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6696a557424c0e91a90398c436814ba05f96caff)
![{\displaystyle {\ce {SiO2 + 6NH4F + 2H2O -> (NH4)2[SiF6] + 4NH3*H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fec3bea53fe08371d2c6b20b85be6cccfc9e2db8)