Фторид тория(IV)
| Фторид тория(IV) | |
|---|---|
 __ Th4+ __ F− | |
| Общие | |
| Систематическое наименование | Фторид тория(IV) |
| Традиционные названия | Торий фтористый |
| Хим. формула | ThF4 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 308,03 г/моль |
| Плотность | 5,71 г/см3[1] |
| Термические свойства | |
| Температура | |
| • плавления | 1110 °C |
| • кипения | 1680 °C |
| Мол. теплоёмк. | 110,709 Дж/(моль·К) |
| Энтальпия | |
| • образования | -209,785 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,17 мг/л |
| Классификация | |
| Рег. номер CAS | 13709-59-6 |
| PubChem | 83680 |
| Рег. номер EINECS | 237-259-6 |
| SMILES | |
| InChI | |
| ChemSpider | 75503 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фтори́д то́рия(IV) (тетрафтори́д то́рия) — бинарное неорганическое соединение, соль металла тория и фтороводородной кислоты с формулой ThF4. Представляет собой бесцветные кристаллы, плохо растворимые в воде.
Получение
- Нагревание металлического тория, гидрида, карбида или диоксида тория с фтором или фтороводородом (исключение — фторирование металлического тория, оно протекает уже при комнатной температуре[2])[3]:
- Реакция гидроксида тория(IV) с концентрированной плавиковой кислотой[4]:
- Гидратированный фторид тория(IV) можно осадить водным раствором плавиковой кислоты из раствора иона Th4+[5]:
- Обезводить его можно нагреванием в атмосфере фтороводорода[5]:
Физические свойства
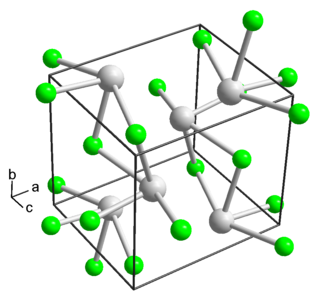
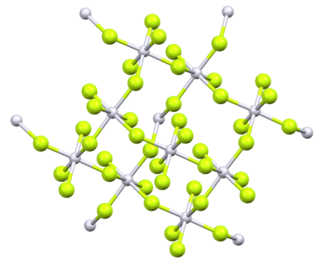
Безводный фторид тория(IV) образует бесцветные кристаллы моноклинной сингонии, пространственная группа I2/c, параметры ячейки a = 1,300 нм, b = 1,0993 нм, c = 0,858 нм, β = 126,4°[3][6]. Изоструктурен кристаллам моноклинной сингонии фторида циркония(IV). Окружение атома тория составляют восемь фторид-ионов, которые расположены в вершинах слегка искажённой квадратной антипризмы[7].
Слабо растворим в воде, плавиковой кислоте, растворим в горячей серной и хлорной кислотах[1]. Образует кристаллогидраты состава ThF4·2H2O и ThF4·4H2O[3]. Гигроскопичен.
Энтальпия образования равна −209,785 кДж/моль[8]. Стандартная энтропия образования составляет 142,047 Дж/(моль·К), уравнение температурной зависимости давления пара: [мм рт. ст.][3].
Химические свойства
- При высокой температуре с диоксидом тория образует оксодифторид тория[5]:
- При высокой температуре с фторидом калия образует двойную соль (фторид тория-дикалия):
- При температуре 900—1000 °C кальцием, магнием, натрием восстанавливается до металлического тория[3]:
- При электролизе фторида тория(IV) в расплаве галогенидов щелочных металлов выделяется металлический торий; температура протекания процесса 800 °C[3].
Примечания
- ↑ 1 2 Никольский и др., том 2, 1971, с. 228—229.
- ↑ Угай, 1997, с. 506.
- ↑ 1 2 3 4 5 6 Кнунянц и др., 1995, с. 614.
- ↑ Лидин, 2000, с. 338.
- ↑ 1 2 3 Коттон и др., 1969, с. 614.
- ↑ Никольский и др., том 1, 1966, с. 503.
- ↑ Гринвуд и др., 2008, с. 587.
- ↑ Никольский и др., том 1, 1966, с. 824.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др. — М.: Советская энциклопедия, 1995. — Т. 4. — 641 с. — ISBN 5-85270-092-4.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Ф. Коттон, Дж. Уилкинсон. Современная неорганическая химия / под ред. М.Е. Дяткиной. — 3-е изд.. — М.: Мир, 1969. — 592 с.
- Справочник химика / Редкол.: Никольский Б.П. и др. — 3-е изд., испр. — Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Гринвуд Н.Н., Эрншо А. Химия элементов. — М.: Бином, 2008. — Т. 2. — 666 с. — ISBN 978-5-9963-1732-5.
- Угай Я.А. Общая и неорганическая химия. — М.: Высшая школа, 1997. — 527 с.