Фторид урана(VI)
| Фторид урана(VI) | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование | Фторид урана(VI) |
| Традиционные названия | гексафторид урана, шестифтористый уран |
| Хим. формула | UF6 |
| Физические свойства | |
| Молярная масса | 351,99 г/моль |
| Плотность | 5,09 г/см3 (тв., 20 °C); 4,9 г/см3 (тв., 50 °C); 13,3 г/л (г., 60 °C)[1] |
| Энергия ионизации | 14 эВ[3] |
| Термические свойства | |
| Температура | |
| • плавления | 64,0 °C (1,44 МПа) |
| • кипения | возгоняется при 56,4 °C |
| Тройная точка | 64,052 °C при 151 кПа[1] |
| Критическая точка | |
| • температура | 230,2 °C[1] °C |
| • давление | 4,61 МПа[1] |
| Энтальпия | |
| • образования | −2317 кДж/моль |
| Удельная теплота испарения | 83,333 Дж/кг (при 64 °C)[1] |
| Удельная теплота плавления | 54,167 Дж/кг (при 64 °C)[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | реагирует |
| Классификация | |
| Рег. номер CAS | [7783-81-5] |
| PubChem | 24560 |
| Рег. номер EINECS | 232-028-6 |
| SMILES | |
| InChI | |
| RTECS | YR4720000 |
| ChEBI | 30235 |
| ChemSpider | 22966 и 23253295 |
| Безопасность | |
| Предельная концентрация | 0,015 мг/м3[2] |
| Токсичность | чрезвычайно токсичен, радиоактивен, сильный окислитель |
| Пиктограммы ECB | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
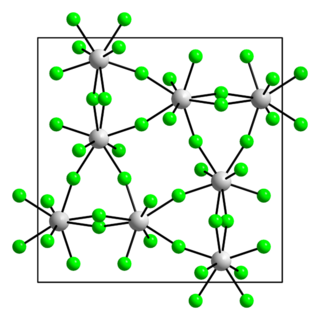
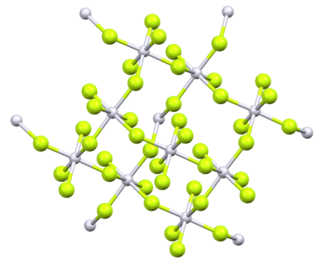
Фтори́д ура́на(VI) (другие названия — гексафторид урана, шестифтористый уран) — бинарное соединение урана со фтором, прозрачные летучие светло-серые кристаллы. Связь уран-фтор в нём носит ковалентный характер. Обладает молекулярной кристаллической решеткой. Очень ядовит, фторирующий агент и сильный окислитель, агрессивно реагирует с органическими веществами.
Является единственным соединением урана, переходящим в газообразное состояние при относительно низкой температуре[1], в связи с этим широко используется в обогащении урана — разделении изотопов 235U и 238U, одном из основных этапов производства топлива для ядерных реакторов и оружейного урана.
Физические свойства


При нормальных условиях гексафторид урана представляет собой светло-серые, желтоватые или прозрачные летучие кристаллы ромбической сингонии, параметры ячейки a = 0,9924 нм, b = 0,8954 нм, c = 0,5198 нм, Z = 4 с плотностью 5,09 г/см3[4]. При атмосферном давлении возгоняется при нагреве до 56,4 °C, однако при небольшом увеличении давления (например, при нагреве в запаянной ампуле) может быть переведён в жидкость. Критическая температура 230,2 °C, критическое давление 4,61 МПа[1].
Энтальпия возгонки ΔH0
возг = 48,07 кДж/моль (56,5 °C). Молярная теплоёмкость C0
p = 167 Дж/(моль·К). Энтальпия образования ΔH0
обр = −2197 кДж/моль. Энтропия S0
298 = 227,6 Дж/(моль·К)[4].
Гексафторид урана радиоактивен, вклад в его радиоактивность вносят все три природных изотопа урана (234U, 235U и 238U). Удельная активность гексафторида урана с природным содержанием изотопов урана (не обеднённого и не обогащённого) составляет 1,7×104 Бк/г; чуть меньше половины активности (48,9%) обусловлено распадом 238U, такая же часть — распадом 234U (эти два природных изотопа урана находятся в радиоактивном равновесии, поэтому их удельная активность в природном уране обычно одинакова); небольшая часть активности (2,3%) обусловлена 235U. Удельная активность обеднённого (то есть с уменьшенным содержанием 235U и 234U) гексафторида урана до двух раз ниже, высокообогащённого по изотопу уран-235 может быть даже на два порядка выше и зависит от степени обогащения ураном-235 и ураном-234[1].
Величины радиоактивности относятся к свежеприготовленному веществу, в котором отсутствуют все дочерние нуклиды уранового ряда, кроме урана-234. Со временем, в течение примерно 150 дней после получения соединения в гексафториде урана накапливаются дочерние изотопы и восстанавливается естественное радиоактивное равновесие по концентрации короткоживущих нуклидов 234Th и 234Pa (дочерние нуклиды урана-238) и 231Th (дочерний нуклид урана-235); в результате удельная активность «старого» гексафторида урана с исходно природным содержанием изотопов увеличивается до 4,0×104 Бк/г[1].
Плотность паров гексафторида урана в большом диапазоне давлений и температур может быть выражена формулой:
где — плотность пара, кг/л;
Давление паров (мм рт. ст.) при температуре (°C) можно найти по следующим эмпирическим формулам[5]:122.
Для диапазона температур 0…64 °C (над твёрдым веществом, точность 0,05 %):
Для диапазона температур 64…116 °C (над жидкостью, точность 0,03 %):
Для диапазона температур 116…230 °C (над жидкостью, точность 0,3 %):
Химические свойства
Бурно реагирует с водой и при нагревании с органическими растворителями; при обычных условиях растворяется в органических растворителях.
Взаимодействуя с водой, образует фторид уранила и фтороводород[1]:
Сильный окислитель. В жидком виде реагирует со многими органическими веществами со взрывом, поэтому в аппаратах, заполняемых гексафторидом урана, нельзя использовать обычные углеводородные смазки, герметизирующие замазки и уплотнители.
Не реагирует с полностью фторированными углеводородами, такими как тефлон или перфторалканы. Не взаимодействует при нормальных условиях с кислородом и азотом, а также с сухим воздухом, однако реагирует с парами воды, содержащимися во влажном воздухе. В отсутствие паров и следов воды не вызывает существенной коррозии алюминия, меди, никеля, монель-металла, алюминиевой бронзы[1].
Взаимодействует с фторидами щелочных металлов (LiF, NaF, KF), фторидом аммония, фторидом нитрозила, некоторыми фторидами щёлочноземельных металлов, образуя фтороуранаты(IV). При нагревании восстанавливается водородом, аммиаком, тетрахлоруглеродом до UF4[4].
Фторид урана(VI) может быть использован в качестве фторирующего реагента в производстве фторорганических соединений. При фторировании органических соединений гексафторид обычно восстанавливается до тетрафторида урана. Процесс фторирования гексафторидом урана идёт с выделением большого количества тепла.
Фторирование непредельных органических соединений сопровождается присоединением фтора по двойной связи[6]. Так, из гексафторпропилена образуется октафторпропан:
- + 424,7 кДж/моль.
Из фтористого винилиденфторида образуется 1,1,1,2-тетрафторэтан[6]:
- + 344,6 кДж/моль.
Фторирование трихлорэтилена сопровождается образованием 1,2-дифтор-1,1,2-трихлорэтана[6]:
Фторирование предельных органических соединений фторидом урана(VI) сопровождается замещением одного или нескольких атомов водорода в исходном соединении на фтор[6]:
- + 219,1 кДж/моль.
Получение
- В российском ядерном топливном цикле: Получается взаимодействием соединений урана (например тетрафторида UF4, оксидов) с F2 (в промышленности реакцию проводят в пламени смеси H2 и F2) или некоторыми другими фторирующими агентами, а затем очищают ректификацией или центрифугированием в газовой центрифуге.
- В американском ядерном топливном цикле: Переработанные в U3O8 («закись-окись урана») урансодержащие руды растворяют в азотной кислоте, получая раствор уранилнитрата UO2(NO3)2. Чистый нитрат уранила получается с помощью жидкостной экстракции (например ТБФ или Д2ЭГФК), а затем, подвергаясь воздействию аммиака, получается диуранат аммония. Восстановление водородом даёт диоксид урана UO2, который затем превращается с помощью плавиковой кислоты HF в тетрафторид урана UF4. Окисление фтором даёт UF6.
Применение


Применяется при разделении изотопов 235U и 238U методами газовой диффузии или центрифугирования для обеспечения делящимся веществом различных ядерных технологий. При этом образуется значительное количество неиспользуемых остатков (обеднённых по урану-235), обычно хранимых в виде гексафторида урана в контейнерах (см. Обеднённый гексафторид урана). Ныне на площадках при обогатительных заводах накоплены огромные количества гексафторида. Общее количество накопившегося гексафторида урана в мире на 2010 год составляет около 2 млн тонн[6].
Обеднённый гексафторид урана используют для фторирования органических соединений. Получаемые с использованием гексафторида урана в качестве фторирующего агента октафторпропан (C3F8, хладон-218, R-218, FC-218) и 1,1,1,2-тетрафторэтан (CF3-CFH2, хладон-134a, R-134, HFC-134a) являются альтернативной заменой озоноразрушающим хладоагентам. Озоноразрушающий потенциал ODP равен нулю. 1,2-Дифтортрихлорэтан (CFCl2CFClH, хладон-122а, R-122a, HCFC-122a) является альтернативной заменой озоноразрушающих фторхлоруглеродных растворителей. Его можно применить в качестве растворителя, экстрагента, вспенивающего агента при производстве полимерных изделий, анестетика для животных[7].
Запасы и утилизация
На конец 2010-х годов в результате изотопного обогащения урана в мире накоплено около 1,5-2 млн тонн обеднённого урана, ежегодно добавляется ещё 40-60 тыс. тонн обеднённого урана[8]. Подавляющая часть этого объёма хранится в виде обеднённого гексафторида урана (ОГФУ) в специальных стальных ёмкостях. По мере совершенствования технологий изотопного обогащения старые запасы ОГФУ иногда дообогащают. Однако длительное хранение столь большого количества химически опасных веществ нежелательно, поэтому существуют технологии конверсии гексафторида урана в менее опасные формы, например оксиды урана или тетрафторид урана UF4.
Известны проекты химической переработки гексафторида во Франции, США, России, Великобритании[8]. Производительность действующих на 2018 год предприятий конверсии ОГФУ — свыше 60 тыс. тонн в год в пересчете на уран. Во Франции конверсия ведётся с 1980-х годов, на 2018 год мощность — 20 тыс. тонн в год. В 2000-х годах две установки мощностью 18 тыс. и 13,5 тыс. тонн в год введены в строй в США. В Великобритании строят установку мощностью 7 тыс. тонн. В России первая промышленная установка по французской технологии введена в строй в 2009 году на Электрохимическом заводе в Зеленогорске (Красноярский край)[8][9]. В 2010 году там же введена в строй установка восстановления ОГФУ в низкотемпературной плазме по российской технологии. Мощность этих двух установок — около 10 тыс. тонн в год. Все эти установки получают закись-окись урана и фтороводород. Также на Ангарском химкомбинате разрабатывают опытно-демонстрационную установку «Кедр» мощностью 2 тыс. тонн в год с получением тетрафторида урана по технологии восстановления ОГФУ в водородном пламени.
Опасность
Биологическая опасность


В России — класс опасности 1, максимальная разовая ПДК в воздухе рабочей зоны — 0,015 мг/м³ (1998 год)[2]. В США предельный пороговый уровень однократного воздействия согласно ACGIH — 0,6 мг/м³ (1995 год).
Чрезвычайно едкое вещество, разрушающее любую живую органику с образованием химических ожогов, реагирует со всеми органическими веществами, кроме тефлона и фторкаучуков. При контакте рекомендуется промывка большим количеством воды. Воздействие паров, аэрозолей и продуктов реакции с влагой воздуха вызывает отёк лёгких и их химический ожог, что очень опасно для жизни. Всасывается в организм через лёгкие или желудочно-кишечный тракт. Очень токсичен, вызывает тяжёлые отравления. Обладает кумулятивным эффектом с поражением печени и почек.
Уран слаборадиоактивен. Загрязнение окружающей среды соединениями урана создаёт риск радиационных аварий.
В нормальных условиях представляет собой быстро возгоняющееся твёрдое вещество, реагирующее с влагой в воздухе с образованием фторида уранила и паров фтороводорода. Парциальное давление паров — 14 кПа. Вокруг твёрдого вещества быстро образуется опасная концентрация паров.
Химическая опасность
Бурно реагирует с водой, в том числе с атмосферной влагой с образованием UO2F2 (фторид уранила) и фтороводорода HF.
Вещество является сильным окислителем. Хорошо реагирует с органическими веществами. Медленно реагирует со многими металлами, образуя фториды металлов. Агрессивен в отношении резины и многих пластиков. Реагирует с ароматическими соединениями типа бензола и толуола.
Пожарная опасность
Не горюч, но при нагреве (в том числе в огне) выделяет едкие токсичные пары. Запрещается применение воды при тушении пожара. Допустимо применение порошковых и углекислотных средств тушения.
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 Appendix II. Properties of UF6 and its reaction products. In: Interim guidance on the safe transport of uranium hexafluoride Архивная копия от 10 сентября 2016 на Wayback Machine. — (IAEA-TECDOC-608). — IAEA, Vienna, 1991. — ISSN 1011-4289.
- ↑ 1 2 ГЕКСАФТОРИД УРАНА. Дата обращения: 21 октября 2016. Архивировано 15 декабря 2019 года.
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 3 Раков Э. Г. Урана фториды // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 45. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ Обогащение урана / Под ред. С. Виллани. — М.: Энергоатомиздат, 1983. — 320 с.
- ↑ 1 2 3 4 5 Орехов В. Т., Рыбаков А. Г., Шаталов В. В. Использование обеднённого гексафторида урана в органическом синтезе. — М.: Энергоатомиздат, 2007. — 112 с. — ISBN 978-5-283-03261-0.
- ↑ Промышленные фторорганические продукты: Справ. изд / Б. Н. Максимов, В. Г. Барабанов, И. Л. Серушкин и др.. — 2-е изд., перераб. и доп. — СПб.: Химия, 1996. — 544 с. — ISBN 5-7245-1043-X.
- ↑ 1 2 3 Наследие обогащения. Дата обращения: 10 ноября 2019. Архивировано 11 ноября 2020 года.
- ↑ Деконверсия ОГФУ — как это делают в Зеленогорске. Дата обращения: 10 ноября 2019. Архивировано 10 ноября 2019 года.