Кисло́ты — химические соединения, способные отдавать катион водорода, либо соединения, способные принимать электронную пару с образованием ковалентной связи.
Сверхкислота́ (или магическая кислота, су̀перкислота́) — комплексное неводное вещество или смесь веществ, параметр кислотности которых превышает кислотность 100%-ой серной кислоты. В данном случае параметр кислотности принимается как способность кислоты протонировать произвольное основание и фактически совпадает с функцией кислотности. Для 100 % серной кислоты параметр кислотности составляет H0 = −12,2. Наличие воды снижает кислотность сверхкислот, так как в присутствии воды сила кислоты ограничивается кислотностью иона гидроксония H3O+.

Бензилхлорид (хлористый бензил) — бесцветная жидкость с резким запахом, нерастворимая в воде, смешивается с этанолом, хлороформом и другими органическими растворителями. Лакриматор, огнеопасен.
Уравне́ние Га́ммета — выражение для линейной зависимости свободных энергий, фундаментального принципа физической органической химии, утверждающее, что количественные изменения реакционной способности в одной реакции из двух схожих коррелируют с количественными изменениями реакционной способности в другой.
Функция кислотности Гаммета — численное выражение способности среды быть донором протонов по отношению к произвольному основанию, безразмерная величина. Количественный параметр в теории Бренстеда-Лоури, в противовес водородному показателю рН в теории Аррениуса.

Джесси Фрэнсис Макклендон — американский химик и физиолог. Известен тем, что первым выполнил внутрижелудочную pH-метрию с помощью аппаратуры собственной конструкции.
Луис Плак Гаммет — американский физикохимик.

Сэр Джон Энтони Попл — английский химик-теоретик, один из основателей современной вычислительной химии. Создатель одной из наиболее широко используемых квантово-химических программ Gaussian. Лауреат Нобелевской премии по химии (1998) и других престижных наград.

N-Бромсукцинимид — N-бромимид янтарной кислоты. Бесцветные кристаллы, нерастворимые в воде. Растворим в полярных апротонных растворителях. Широко применяется в синтетической органической химии в качестве бромирующего реагента, в кислой среде является источником катионов брома.
Нуклеофил в химии — реагент, образующий химическую связь с партнером по реакции (электрофилом) по донорно-акцепторному механизму, предоставляя электронную пару, образующую новую связь. Вследствие того, что нуклеофилы отдают электроны, они по определению являются основаниями Льюиса. В роли нуклеофилов теоретически могут выступать все ионы и нейтральные молекулы с неподеленной электронной парой.

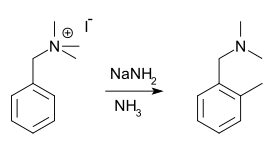
Реакция Соммле-Хаузера — это реакция перегруппировки, возникающая при обработке амидами щелочных металлов бензильных четвертичных аммониевых солей. Продукт реакции, третичный бензиламин, может подвергаться дальнейшему алкилированию и затем снова претерпевать перегруппировку. Процесс можно продолжать, ведя алкилирование по циклу до второго орто-положения.

Биоортогональные реакции — химические реакции, которые способны протекать внутри живых систем, не мешая естественным биохимическим процессам. Функциональные группы, участвующие в биоортогональных реакциях, как правило, не встречаются в биомолекулах, быстро и селективно реагируют друг с другом в условиях живой клетки и при этом являются инертными по отношению к другим соединениям, которые присутствуют в организме. Термин был предложен Каролин Бертоцци в 2003 году. Название реакций основано на переносном значении слова «ортогональный», то есть независимый от чего-либо, и обозначает взаимную независимость протекания искусственных и естественных процессов.

Рóджер Áдамс — американский химик-органик. Наиболее известен открытием катализатора Адамса, работами по структурной химии и стереохимии природных соединений, таких как антрахиноны, хаульмуровая кислота и госсипол. Он обучил порядка 250 докторов наук (Ph.D.) и научных сотрудников в Иллинойсе, сыграл ключевую роль в развитии обучения специалистов и промышленных исследований, занимался исследованием боевых газов для американской армии в течение первой и второй мировых войн.

Говард Симмонс — американский химик-органик, известный благодаря своим новаторским работам в различных областях химии. На протяжении почти всей жизни работал в крупной американской химической компании DuPont.
Фрэ́нк Кли́ффорд Уи́тмор — американский химик-органик.

Пластоцианин — медьсодержащий белок, вовлечённый в транспорт электронов от фотосистемы II к фотосистеме I. Этот мономерный белок, состоящий у большинства сосудистых растений из 99 аминокислот, имеет молекулярную массу около 10,5 кДа. Он является представителем пластоцианинового семейства медьсвязывающих белков.
Фтороплутонат(V) рубидия — неорганическое соединение, комплексный фторид плутония и рубидия с формулой Rb2PuF7, зелёные кристаллы.
Роберт Арнольд Алберти — американский био- и физикохимик. Внёс значительный вклад в современную термодинамику биологических систем, а также кинетику ферментативных реакций. Развивал метод электрофореза. Внедрил в практику исследований ферментативных реакций различные физико-химические методы, такие как метод ядерного магнитного резонанса, спектрофотометрии, изотопного замещения. Сформулировал идею о быстром равновесии в реакциях, катализируемых ферментами.

Пол Даути Бартлетт — американский химик-органик, основатель школы физической органической химии, член Национальной АН США.
Франклин Эсбери Лонг — американский химик и общественный деятель, основная сфера научных интересов — исследование механизмов химических реакций в растворах.










