Хлорид диспрозия(III)
| Хлорид диспрозия(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Хлорид диспрозия(III) |
| Традиционные названия | Хлористый диспрозий, трихлорид диспрозия |
| Хим. формула | DyCl3 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 268,86 г/моль |
| Плотность | 3,617; 3,67 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 947; 654; 718 °C |
| • кипения | 1530; 1627 °C |
| Мол. теплоёмк. | 96,86 Дж/(моль·К) |
| Энтальпия | |
| • образования | −983 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 74,1 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10025-74-8 |
| PubChem | 66207 |
| Рег. номер EINECS | 233-039-9 |
| SMILES | |
| InChI | |
| ChemSpider | 59592 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид диспрозия(III) — неорганическое соединение, соль диспрозия и соляной кислоты с формулой DyCl3, бесцветные кристаллы, хорошо растворяется в воде, образует кристаллогидрат. Относится к группе химических соединений трихлоридов лантаноидов с формулой LnCl3, где Ln обозначает металл-лантаноид.
Получение
- Действие газообразного хлористого водорода на опилки диспрозия:
- Хлорирование металлического диспрозия:
- Взаимодействие смеси хлора с тетрахлорметаном и оксалатом диспрозия(III).
Физические свойства
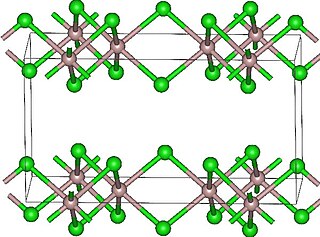
Хлорид диспрозия(III) образует бесцветные кристаллы моноклинной сингонии, пространственная группа C 2/m, параметры ячейки a = 0,691 нм, b = 1,197 нм, c = 0,640 нм, β = 111,2°, Z = 4.
Хорошо растворяется в воде.
Образует кристаллогидрат состава DyCl3•6H2O.
Химические свойства
- При нагревании кристаллогидрата происходит частичный гидролиз:
- Обезвоживание кристаллогидрата проводит при нагревании в вакууме в присутствии хлорида аммония для подавления гидролиза:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М.: Мир, 1985. — Т. 4. — 447 с.