Хлорид неодима(III)
| Хлорид неодима(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Хлорид неодима(III) |
| Традиционные названия | Хлористый неодим |
| Хим. формула | NdCl3 |
| Физические свойства | |
| Состояние | розово-фиолетовые кристаллы |
| Молярная масса | 250,60 г/моль |
| Плотность | 4,134; гидрат - 2,282 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 758; 759; 760; 773; 784 °C |
| • кипения | 1600; 1612; 1690 °C |
| Мол. теплоёмк. | 99,2 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1040 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 96,80; 10025; 140100 г/100 мл |
| • в этаноле | 44,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10024-93-8, 13477-89-9 |
| PubChem | 66204 и 10131187 |
| Рег. номер EINECS | 233-031-5 |
| SMILES | |
| InChI | |
| ChemSpider | 59589 |
| Безопасность | |
| ЛД50 | 4 г/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид неодима(III) — бинарное неорганическое соединение, соль металла неодима и соляной кислоты с формулой NdCl3, розово-фиолетовые кристаллы, растворимые в воде, образует кристаллогидраты.
Получение
- Реакция соляной кислоты с металлическим неодимом, оксидом или гидроксидом:
- Безводную соль получают нагреванием смеси кристаллогидрата и хлорида аммония в вакууме для предотвращения гидролиза:
Физические свойства
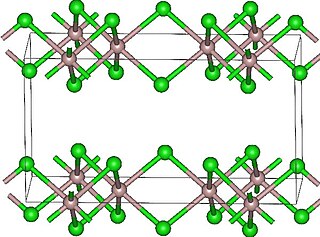
Хлорид неодима(III) образует розово-фиолетовые кристаллы гексагональной сингонии, пространственная группа P 63/m, параметры ячейки a = 0,7381 нм, c = 0,4231 нм, Z = 2.
Хорошо растворяется в воде, этаноле. Не растворяется в диэтиловом эфире, хлороформе.
Образует кристаллогидраты состава NdCl3•6H2O — красные кристаллы, которые плавятся в собственной кристаллизационной воде при 124°С.
Химические свойства
- Вступает в обменные реакции:
- Реагирует с бромо- и иодоводородами:
- При нагревании кристаллогидрат разлагается с гидролизом:
- Неодим вытесняется из хлорида активными металлами:
Применение
- Получение неодима металлотермическим методом.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М.: Мир, 1985. — Т. 4. — 447 с.
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
- Химия и технология редких и рассеянных элементов, ч. II / Под ред. К. А. Большакова. — М.: Высш. школа, 1976. — 360 с.
- CRC Handbook of Chemistry and Physics[англ.]. — 89th Edition. — Taylor and Francis Group, LLC, 2008-2009.