Хлорид таллия(I)
| Хлорид таллия(I) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Хлорид таллия |
| Традиционные названия | Хлористый таллий |
| Хим. формула | TlCl |
| Рац. формула | TlCl |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 239,84 г/моль |
| Плотность | 7,0; 7,02 г/см³ |
| Энергия ионизации | 9,7 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | 430; 431 °C |
| • кипения | 806; 818; 820 °C |
| Мол. теплоёмк. | 50,9 Дж/(моль·К) |
| Энтальпия | |
| • образования | -204 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 3.3 g/L (25 °C) |
| Структура | |
| Дипольный момент | 1,5E−29 Кл·м[1] |
| Классификация | |
| Рег. номер CAS | 7791-12-0 |
| PubChem | 24642 |
| Рег. номер EINECS | 232-241-4 |
| SMILES | |
| InChI | |
| ChEBI | 37117 |
| ChemSpider | 23044 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлори́д та́ллия(I) (монохлори́д та́ллия) — бинарное неорганическое соединение, соль металла таллия и соляной кислоты с формулой TlCl, бесцветные кристаллы, плохо растворимые в воде.
Получение
- Непосредственное взаимодействие элементов:
- Действием соляной кислоты на оксид, гидроксид или карбонат таллия:
- Обменными реакциями:
Физические свойства
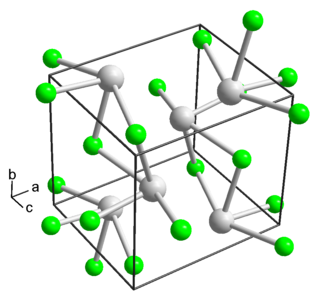
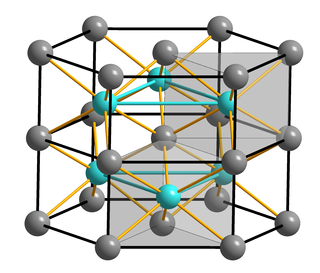
Хлорид таллия образует бесцветные кристаллы кубической сингонии, пространственная группа P m3m, параметры ячейки a = 0,38421 нм, Z = 1.
Химические свойства
- Светочувствительный, под действием света обратимо разлагается:
- Разлагается концентрированной серной кислотой:
- Окисляется концентрированной азотной кислотой:
- и хлором:
- Восстанавливается при нагревании водородом:
Применение
- Монокристаллы хлорида таллия используются в оптических элементах для приборов ИК-техники, акустооптики, лазерной техники, как заготовки для получения волоконных световодов.
Токсичность
Как и сам таллий и все соли таллия, хлорид таллия (I) является ядовитым.
См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Примечания
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5





![{\displaystyle {\mathsf {2TlCl\ {\stackrel {\xrightarrow {h\nu }}{\xleftarrow[{\ \ \ }]{}}}\ 2TlCl_{1-x}+xCl_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05cbcdef757f28bb52767e750457365f7b7b67f2)