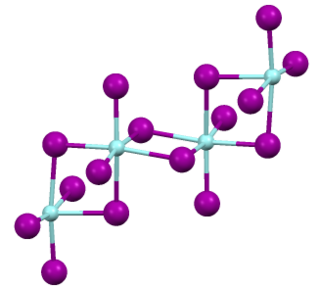
Хлорид циркония(II)
| Хлорид циркония(II) | |
|---|---|
| Общие | |
| Систематическое наименование | Хлорид циркония(II) |
| Хим. формула | ZrCl2 |
| Физические свойства | |
| Состояние | кристалл |
| Молярная масса | 162,13 г/моль |
| Плотность | 3,6 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 722 °C |
| • кипения | разл. °C |
| Энтальпия | |
| • образования | −404,6 кДж/моль |
| Классификация | |
| Рег. номер CAS | 13762-26-0 |
| PubChem | 143120 |
| SMILES | |
| InChI | |
| ChemSpider | 126253 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлори́д цирко́ния(II) (дихлори́д цирко́ния) — бинарное неорганическое соединение, соль металла циркония и соляной кислоты с химической формулой ZrCl2. Вещество чёрного цвета.
Получение
- Образуется при восстановлении тетрахлорида циркония до трихлорида (при нагревании до 350 °C в запаянной трубке с порошком алюминия в присутствии хлорида алюминия) и диспропорционировании трихлорида циркония при его дальнейшем нагревании без доступа воздуха[1]:
- Образуется при нагревании циркония в парах тетрахлорида циркония[1]:
Физические свойства
Образует чёрные кристаллы с плотностью 3,6 г/см3. Малорастворим в спирте и бензоле. При нагревании растворяется в концентрированных кислотах. Температура плавления 722 °C, разлагается ниже температуры кипения. Теплоёмкость C0
p = 74 Дж/(моль·К), энтальпия образования ΔH0
обр = −404,6 кДж/моль, энтропия S0
298 = 110 Дж/(моль·К)[2].
Использование
Существует метод разделения циркония и гафния, основанный на различной устойчивости их низших хлоридов (в частности, дихлоридов)[3][4]. Отделение циркония от гафния, близкого по химическим свойствам, но обладающего высоким сечением захвата тепловых нейтронов, важно для производства ядерных реакторов.
См. также
Примечания
- ↑ 1 2 Реми Г. Курс неорганической химии. — М.: Мир, 1966. — Т. 2. — С. 86.
- ↑ Раков Э. Г. Циркония галогениды // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 386—387. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ Ягодин Г. А., Синегрибова О. А., Чекмарев А. М. Технология редких металлов в атомной технике. Учебное пособие для вузов. Под ред. Б. В. Громова. — М.: Атомиздат, 1974, 344 с. — С. 90—91.
- ↑ Шека И. А., Карлышева К. Ф. Химия гафния. — Киев: Наукова думка, 1974. — С. 45—46.
![{\displaystyle {\mathsf {3ZrCl_{4}+Al\ {\xrightarrow[{AlCl_{3}}]{350^{o}C}}\ 3ZrCl_{3}+AlCl_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d3deadd5bc0039ab63b2466c043cf427902308c9)