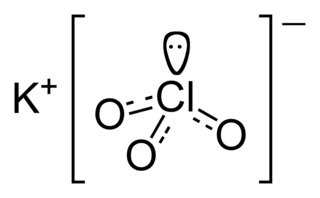
Хлорная известь
Хло́рная и́звесть (белильная известь, в просторечии хло́рка) — смешанный хлорид-гипохлорит кальция или техническая смесь гипохлорита, хлорида и гидроксида кальция.
Процесс производства отбеливающего порошка из хлора и гашёной извести изобретён в 1799 году Чарльзом Теннантом.
Получение
Получают при взаимодействии хлора с гидроксидом кальция. Реакция протекает по нескольким путям:
В зависимости от условий (температура, влажность) может происходить смещение в пользу выхода гипохлорита или хлорида кальция. Реальный продукт, получаемый хлорированием гидроксида кальция, является смесью соединений, образованных молекулами Ca(ClO)2, CaCl2, Ca(OH)2 и кристаллизационной воды. Если исходный гидроксид был достаточно чистым, а обработка хлором велась до полного насыщения и с соблюдением температурного режима, то состав свежеприготовленной хлорной извести может быть довольно точно выражен формулой Ca(OCl)2·CaCl2·Ca(OH)2·2H2O, которую для большего удобства можно формализовать как 3Ca(OH)2·2Cl2.
Свойства
При обычных условиях хранения хлорная известь медленно разлагается, в основном, по схеме
- ,
теряя при этом около 5 % активного хлора в год.
Под действием влажного воздуха, содержащего углекислый газ, хлорная известь превращается в хлорноватистую кислоту[1]:
- .
При действии соляной кислоты на хлорную известь выделяется хлор:
- ,
- (термическое разложение),
- .
В растворе (при нагревании или на свету), содержащийся в смеси гипохлорит подобно другим гипохлоритам диспропорционирует:
- .
Применение, опасность применения
Широко используется для отбеливания и дезинфекции, а также для удаления известкового налёта.[2]
В прошлом применялась в промышленной добыче золота методом хлоринационного выщелачивания. Выделяющийся при реакции гипохлорита кальция и соляной кислоты хлор реагировал с золотом с образованием водорастворимых хлоридов золота.[3]


Хлорная известь — едкое, коррозионно-активное вещество. Вещество умеренно-токсично. LD50 на крысах — 850 мг/кг[4][].
Гипохлорит и гидроксид кальция принадлежат к III классу опасности в соответствии с ГОСТ 12.1.007-76.
ПДК хлора в рабочей зоне — 1 мг/м3 (класс опасности 2 по гигиеническим нормативам)[5][].
Примечания
- ↑ Н. Е. Кузьменко, В. В. Еремин, В. А. Попков. Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов. — 17-е изд. — Лаборатория знаний, 2017. — С. 293.
- ↑ "Как удалить известковый налет". 2018-03-14. Архивировано 25 октября 2018. Дата обращения: 24 октября 2018.
- ↑ Гидрохлорирование золотосодержащих руд, история проблемы Архивная копия от 19 января 2019 на Wayback Machine.
- ↑ Источник. Дата обращения: 16 июня 2020. Архивировано 8 марта 2022 года.
- ↑ https://www.safework.ru/Хлор
Литература
- Зефиров Н. С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9.
- Менделеев Д. И. Основы химии. — Москва, Ленинград, ГНТИХЛ, 1947.
Ссылки
- Крупский А. К., Менделеев Д. И. Известь, в технике // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.