Хромосомная нестабильность
Хромосомная нестабильность (англ. Chromosomal instability) (CIN) — один из видов геномной нестабильности, при которой в дочерних поколениях делящихся клеток наблюдаются неклональные изменения кариотипа, а именно: потери или приобретения хромосом и их участков.
Хромосомная нестабильность наблюдается в злокачественных клетках при некоторых лейкозах и в клетках некоторых со́лидных опухолей, особенно часто наблюдается при раке прямой кишки[1]. Хотя многие опухоли являются анеуплоидными и/или несут хромосомные перестройки, для раков с хромосомной нестабильностью характерна крайне высокая частота хромосомных аномалий и высокое их разнообразие[2].
Критерии для определения CIN
- Так как хромосомная нестабильность определяется скоростью накопления хромосомных нарушений, для выявления хромосомной нестабильности необходимо проводить сравнительный количественный анализ клеточных популяций с использованием статистических методов[3].
- Частота хромосомных нарушений в тестируемой клеточной популяции должна сравниваться с контрольной клеточной популяцией. Это особенно верно при низких частотах хромосомных аберраций[3].
- Частота хромосомных нарушений должна быть нормирована на количество клеточных делений, которые претерпевает клеточная популяция[3].
- Анализ хромосомной нестабильности должен определять не только полный рейтинг изменения хромосом, но и частичные изменения, такие как хромосомные делеции, вставки, инверсии и усиления, также следует учитывать сегментные анеуплоидии[3]. Это обеспечивает более точное определение наличия хромосомной нестабильности.
- Результаты для полиплоидных и диплоидных клеток должны быть идентифицированы и записаны отдельно друг от друга. Это потому, что фитнес-стоимость (выживание в следующем поколении) хромосомной нестабильности ниже в полиплоидных клетках, а клетка имеет большее число хромосом, чтобы компенсировать испытываемую хромосомную нестабильность[3].
- При определении наличия и степени хромосомной нестабильности должно быть принято во внимание, что полиплоидные клетки более склонны к хромосомным изменениям[3].
Классификация
Численное значение CIN определяется высотой рейтинга каждой цепочки или потерей целых хромосом; в результате чего возникает анеуплоидия. Нормальные клетки производят ошибки в сегрегации хромосом в 1% клеточных делений, в то время как клетки с CIN производят эти же ошибки примерно в 20% клеточных делений. Поскольку анеуплоидия — общая черта в опухолевых клетках, наличие анеуплоидии в клетках, не обязательно означает, присутствия CIN; CIN определяется высоким уровнем ошибок[4]. Один из способов дифференциации без CIN и CIN-индуцированной анеуплоидии заключается в том, что CIN вызывает широкие переменные (гетерогенные) хромосомные аберрации; тогда, когда CIN не является причинным фактором, хромосомные изменения часто более клонального типа[5].
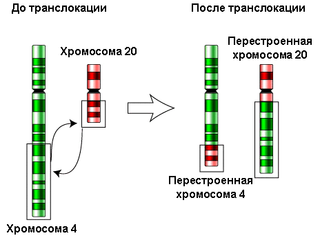
Структурная CIN отличается тем, что могут быть дублированы или удалены фрагменты хромосом вместо целых хромосом. Перестановка частей хромосом (транслокация) и дополнения и делеции в хромосомах могут также происходить при структурном CIN[4].
Эффекты
CIN часто приводит к анеуплоидии. Существуют три пути, которые ведут к анеуплоидии. Это может произойти из-за потери целой хромосомы, прироста целой хромосомы или перегруппировки частных хромосом, известных как большие хромосомные перестройки (GCR). Все эти признаки являются признаками некоторых видов рака[6]. Сегментарная анеуплоидия может произойти из-за делеции, уплотнения или транслокации, которые возникают из поломок в ДНК[3], а потери и прирост целых хромосом — часто из-за ошибок во время митоза.
Целостность генома
Хромосомы состоят из последовательности ДНК и белков (таких как гистоны), которые отвечают за их упаковку в хромосоме. Поэтому, когда речь идет о нестабильности хромосом, эпигенетические изменения могут также вступать в игру. Гены, с другой стороны, относятся только к последовательности ДНК (наследственный модуль), и совершенно не обязательно брать в расчёт, что они будут экспрессированы в качестве только эпигенетических факторов. Расстройства, такие как нестабильность хромосом, могут быть унаследованы с помощью генов, или приобретены позднее из-за воздействия окружающей среды. Один из путей приобретения хромосомной нестабильности — результат воздействия ионизирующего излучения[7]. Известно, что излучение причиняет вред ДНК, что может вызвать ошибки в репликации клеток, которые могут привести к хромосомной нестабильности. Хромосомная нестабильность может, в свою очередь, вызвать рак. Тем не менее, синдромы хромосомной нестабильности, такие как синдром Блума, атаксия телеангиэктазия и анемия Фанкони наследуется[7] и считаются генетическими заболеваниями. Эти расстройства опухолевого генеза, часто имеют также индивидуальный фенотип. Гены, контролирующие нестабильность хромосом известны как гены хромосомной нестабильности и они контролируют пути митоза, репликации ДНК, ремонт и модификацию[8]. Они также контролируют транскрипцию и процесс ядерной транспортировки[8].
Хромосомная нестабильность и рак
Исследования, связанные с хромосомной нестабильностью, связаны с твердыми опухолями, которые, в свою очередь, связаны с твёрдой массой раковых клеток, которые растут в системных органах и могут образоваться в любой части тела. Эти опухоли отличаются от жидких опухолей, которые происходят в крови, костном мозге, лимфатических узлах и т. п.[9].
Несмотря на то, хромосомная нестабильность уже давно считается вносящей свой вклад в развитие опухоли, недавние исследования показали, что хромосомная нестабильность может либо способствовать либо подавлять развитие опухоли[6]. Разница между двумя действиями зависит от количества хромосомной нестабильности, так как невысокий рейтинг хромосомной неустойчивости приводит к опухолевой прогрессии, или другими словами, к раку, в то время как высокий рейтинг хромосомной нестабильности часто приводит к гибели раковых клеток[10]. Это связано с тем, что высокий рейтинг хромосомной нестабильности наносит ущерб механизмам выживания клетки[10], и раковая клетка не может реплицировать и умирает (апоптоз). Поэтому зависимость между хромосомной нестабильностью и раком также могут быть использована для оказания помощи в диагностике вида опухоли (злокачественная или доброкачественная)[10].
Большинство твердых злокачественных опухолей человека характеризуется хромосомной нестабильностью и приростом или потерей целых хромосом или их фрагментов[3]. Например, большинство колоректальных и других твердых раков сопровождается хромосомной нестабильностью (CIN)[11]. Это показывает, что хромосомная нестабильность может нести ответственность за развитие твердых раков. Тем не менее, генетические изменения в опухоли не обязательно означают, что опухоль генетически неустойчива, так как «нестабильность генома» относится к различным нестабильностям фенотипов, в том числе и фенотипа хромосомной нестабильности[3].
Роль CIN в канцерогенезе основательно обсуждалась[12]. В то время как некоторые утверждают каноническую теорию активации онкогенов и инактивации генов супрессоров опухолей, такие как Роберт Вайнберг, некоторые утверждают, что CIN может играть важную роль в происхождении раковых клеток, так как CIN предоставляет мутатор фенотипа[13], что позволяет клетке накапливать большое количество мутаций. Учёные, участвующие в этой дискуссии включают в себя Кристофа Ленгауэра, Кеннет Кинзлера, Кейт Р. Леба, Лоуренс А. Лоэба, Берта Фогельштейна и Питера Дюсберга.
Методы диагностики
Диагноз хромосомной нестабильности может быть поставлен с помощью аналитических методов на клеточном уровне. Часто используемыми средствами для диагностики CIN является цитогенетика проточной цитометрии, сравнительная геномная гибридизация[англ.] и полимеразная цепная реакция[3], кариотипирование и флуоресценция в гибридизации (FISH) и другие методы, подходящие для использования[14]. В сравнительной геномной гибридизации, ДНК извлекается из больших клеточных популяций, вероятно, что будут определены некоторые приобретения и потери[3]. Кариотипирование используется при анемии Фанкони, основываясь на 73-часовых культурах цельной крови, которые затем подкрашивали красителем Гимза. После окрашивания под микроскопом видны аберрации хроматидного типа[15].
См. также
- Нестабильность микросателлитных повторов[англ.], другая форма геномной нестабильности.
Примечания
- ↑ Lengauer, C.; K. W. Kinzler; B. Vogelstein. Genetic instability in colorectal cancers (англ.) // Nature. — 1997.
- ↑ Geigl J. B., Obenauf A. C., Schwarzbraun T., Speicher M. R. Defining 'chromosomal instability' (англ.) // Trends Genet.[англ.] : journal. — 2008. — February (vol. 24, no. 2). — P. 64—9. — doi:10.1016/j.tig.2007.11.006. — PMID 18192061.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Geigl, Jochen B.; Obenauf, Anna C.; Schwarzbraun, Thomas; Speicher, Michael R. Defining ‘chromosomal instability’ (англ.) // Trends in Genetics[англ.] : journal. — Cell Press. — Vol. 24, no. 2. — P. 64—69. — doi:10.1016/j.tig.2007.11.006. — PMID 18192061.
- ↑ 1 2 McGranahan N., Burrell R. A., Endesfelder D., Novelli M. R., Swanton C. Cancer chromosomal instability: therapeutic and diagnostic challenges (англ.) // EMBO Rep.[англ.] : journal. — 2012. — June (vol. 13, no. 6). — P. 528—538. — doi:10.1038/embor.2012.61. — PMID 22595889.
- ↑ Bakhoum S. F., Compton D. A. Chromosomal instability and cancer: a complex relationship with therapeutic potential (англ.) // J. Clin. Invest. : journal. — 2012. — April (vol. 122, no. 4). — P. 1138—1143. — doi:10.1172/JCI59954. — PMID 22466654. — PMC 3314464.
- ↑ 1 2 Yuen, Karen; Wing Yee. Chromosome Instability (CIN), Aneuploidy and Cancer (англ.) // Encyclopedia of LIfe Sciences : journal. — 2010.
- ↑ 1 2 Wright, Eric G. Inherited and inducible chromosomal instability: a fragile bridge between genome integrity mechanisms and tumourigenesis (англ.) // The Journal of Pathology[англ.] : journal. — 1999. — 1 January (vol. 187, no. 1). — P. 19—27. — doi:10.1002/(SICI)1096-9896(199901)187:1<19::AID-PATH233>3.0.CO;2-1.
- ↑ 1 2 Stirling, Peter C.; Bloom, Michelle S.; Solanki-Patil, Tejomayee; Smith, Stephanie; Sipahimalani, Payal; Li, Zhijian; Kofoed, Megan; Ben-Aroya, Shay; Myung, Kyungjae; Hieter, Philip; Snyder, Michael. The Complete Spectrum of Yeast Chromosome Instability Genes Identifies Candidate CIN Cancer Genes and Functional Roles for ASTRA Complex Components (англ.) // PLoS Genetics[англ.] : journal. — Vol. 7, no. 4. — P. e1002057. — doi:10.1371/journal.pgen.1002057.
- ↑ National Cancer Institute Definition of Solid Tumors. Дата обращения: 1 апреля 2013. Архивировано 11 мая 2015 года.
- ↑ 1 2 3 Dabas, Nitika; Byrnes, Diana M.; Rosa, Ashley M.; Eller, Mark S.; Grichnik, James M. Diagnostic Role of Chromosomal Instability in Melanoma (англ.) // Journal of Skin Cancer : journal. — 2012. — 1 January (vol. 2012). — P. 1—7. — doi:10.1155/2012/914267.
- ↑ Michor, Franziska; Iwasa, Yoh; Vogelstein, Bert; Lengauer, Christoph; Nowak, Martin A. Can chromosomal instability initiate tumorigenesis? (англ.) // Seminars in Cancer Biology : journal. — Vol. 15, no. 1. — P. 43—49. — doi:10.1016/j.semcancer.2004.09.007.
- ↑ Gibbs, W. Wayt. Untangling the Roots of Cancer (англ.) // Scientific American. — Springer Nature, 2008. — July (vol. 18). — P. 30—39. — doi:10.1038/scientificamerican0708-30sp.
- ↑ Loeb, Lawrence A. A Mutator Phenotype in Cancer (англ.) // Cancer Research[англ.]. — American Association for Cancer Research[англ.], 2001. — Vol. 61. — P. 3230—3239. Архивировано 15 мая 2019 года.
- ↑ Sakamoto Hojo, E.T.; van Diemen, P.C.M.; Darroudi, F.; Natarajan, A.T. Spontaneous chromosomal aberrations in Fanconi anaemia, ataxia telangiectasia fibroblast and Bloom's syndrome lymphoblastoid cell lines as detected by conventional cytogenetic analysis and fluorescence in situ hybridisation (FISH) technique (англ.) // Mutation Research[англ.] : journal. — Elsevier. — Vol. 334, no. 1. — P. 59—69. — doi:10.1016/0165-1161(95)90031-4.
- ↑ Oostra, Anneke B.; Nieuwint, Aggie W. M.; Joenje, Hans; de Winter, Johan P. Diagnosis of Fanconi Anemia: Chromosomal Breakage Analysis (англ.) // Anemia : journal. — 2012. — 1 January (vol. 2012). — P. 1—9. — doi:10.1155/2012/238731.