Церий
| Церий | ||||
|---|---|---|---|---|
| ← Лантан | Празеодим → | ||||
| ||||
| Внешний вид простого вещества | ||||
 Образец церия | ||||
| Свойства атома | ||||
| Название, символ, номер | Це́рий / Cerium (Ce), 58 | |||
| Группа, период, блок | 3 (устар. IIIB), 6, f-элемент | |||
| Атомная масса (молярная масса) | 140,116(1)[1] а. е. м. (г/моль) | |||
| Электронная конфигурация | [Xe]4f15d16s2[2] | |||
| Радиус атома | 181 пм | |||
| Химические свойства | ||||
| Ковалентный радиус | 165 пм | |||
| Радиус иона | (+4e) 92 103.(+3e) 4 пм | |||
| Электроотрицательность | 1,12 (шкала Полинга) | |||
| Электродный потенциал | Ce←Ce3+ −2,34 В | |||
| Степени окисления | +2, +3, +4 | |||
| Энергия ионизации (первый электрон) | 540,1 (5,60) кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) | 6,757 г/см³ | |||
| Температура плавления | 1072 K (798,85 °С) | |||
| Температура кипения | 3699 K (3425,85 °С) | |||
| Мол. теплота плавления | 5,2 кДж/моль | |||
| Мол. теплота испарения | 398 кДж/моль | |||
| Молярная теплоёмкость | 26,94[3] Дж/(K·моль) | |||
| Молярный объём | 21,0 см³/моль | |||
| Кристаллическая решётка простого вещества | ||||
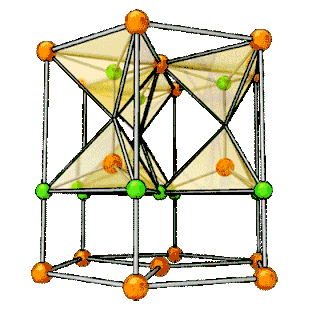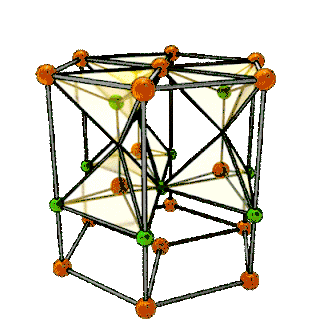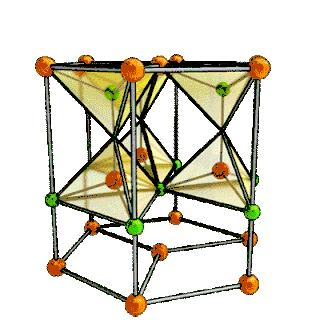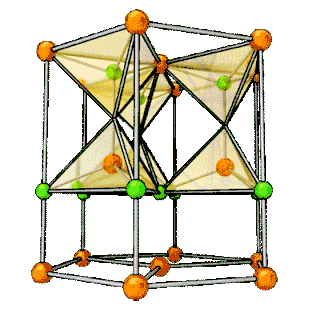
| Структура решётки | Кубическая гранецентрированная | |||
| Параметры решётки | 5,160 Å | |||
| Прочие характеристики | ||||
| Теплопроводность | (300 K) 11,3 Вт/(м·К) | |||
| Номер CAS | 7440-45-1 | |||
| 58 | Церий |
| 4f15d16s2 | |
Це́рий (химический символ — Ce, от лат. Cerium) — химический элемент 3-й группы (по устаревшей классификации — побочной подгруппы третьей группы, IIIB) шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 58.
Относится к лантаноидам.
Простое вещество церий — это мягкий, пластичный редкоземельный металл серебристого цвета. Легко окисляется на воздухе.
История
Назван в честь самой большой из малых планет, Цереры (Ceres), в свою очередь, названной в честь римской богини плодородия.
Немецкий химик М. Г. Клапрот, открывший цериевую землю в 1803 г. почти одновременно со своими шведскими коллегами — В. Хизингером и Й. Я. Берцелиусом, возражал против названия «церий», предлагая «церерий». Берцелиус, однако, отстоял своё название, ссылаясь на трудности произношения того имени, которое предлагал новому элементу Клапрот.
Нахождение в природе
Содержание церия в земной коре — 70 г/т, в воде океанов — 5,2⋅10−6 мг/л[4].
Физические свойства
Полная электронная конфигурация атома церия: 1s22s22p63s23p64s23d104p65s24d105p66s24f15d1
Церий — это вязкий и ковкий серебристый металл, легко поддающийся ковке и механической обработке при комнатной температуре.
Известны 4 кристаллические модификации:
- α-форма с кубической кристаллической решёткой типа Cu до температуры 95K
- β-форма с гексагональной кристаллической решёткой типа La в интервале температур 95—264К
- γ-форма с кубической кристаллической решёткой типа Cu в интервале температур 263—1035K
- δ-форма с кубической кристаллической решёткой типа α-Fe при температурах выше 1035K
Химические свойства
Церий — это редкоземельный металл, неустойчив на воздухе, постепенно окисляется, превращаясь в белый оксид и карбонат церия. При нагревании до +160…+180 °C на воздухе загорается; порошок церия является пирофорным.
Церий реагирует с кислотами, при кипячении окисляется водой, устойчив к действию щелочей. Энергично взаимодействует с галогенами, халькогенами, азотом и углеродом.
Получение
Церий выделяют из смеси редкоземельных элементов процессами экстракции и хроматографии. Получают электролизом расплава фторида церия CeF3.
Применение
Металлургия
В современной технике широко используют способность церия (как и других лантаноидов) модифицировать сплавы на основе железа, магния; добавление 1% церия к магнию резко увеличивает прочность последнего на разрыв и сопротивление ползучести.
Легирование конструкционных сталей церием значительно повышает их прочность. Здесь действие церия в целом аналогично действию лантана. Но поскольку церий и его соединения дешевле и доступнее лантана, то значение церия как легирующей добавки больше.
Легирование церием алюминия увеличивает его прочность и снижает электропроводность (величина изменений зависит от концентрации церия в сплаве, а также от способа получения сплава).
Стоит отметить то обстоятельство, что церий с рядом металлов при сплавлении реагирует весьма бурно с образованием интерметаллидов. Так, весьма характерна для церия бурная реакция с цинком при сплавлении или при локальном нагревании смеси порошка церия с порошком цинка. Эта реакция протекает в форме мощного взрыва, поэтому весьма опасно прибавление кусочка церия к расплавленному цинку — происходит яркая вспышка и сильный взрыв.
Катализаторы
В химической и нефтяной промышленности диоксид церия СеО2 (температура плавления 2600 °C) используют как катализатор. В частности, CeO2 хорошо ускоряет практически важную реакцию между водородом и окисью углерода (Водяной газ). Так же хорошо и надёжно работает диоксид церия в аппаратах, где происходит дегидрогенизация спиртов. Другое соединение церия — его сульфат Ce(SO4)2 — считают перспективным катализатором для сернокислого производства. Он намного ускоряет реакцию окисления сернистого ангидрида в серный.
Получение и измерение сверхнизких температур
Церий-магниевый нитрат (ЦМН) Ce2Mg3(NO3)12·24H2O используют в магнитных термометрах и как вещество для адиабатического размагничивания[5][6][7].
Термоэлектрические материалы
Сульфид церия применяется в качестве высокотемпературного термоэлектрического материала с высокой эффективностью, для увеличения эффективности обычно легируется сульфидом стронция.
Производство стекла
В атомной технике широко применяют церий-содержащие стёкла — они не тускнеют под действием радиации, (так как образующиеся центры окраски не поглощают свет в видимом глазом диапазоне), позволяя изготавливать толстые стёкла для защиты персонала.
Диоксид церия церит входит в состав специальных стёкол как осветлитель и иногда как светло-жёлтый краситель.
Оксид церия(IV) совместно с диоксидом титана используется для варки цветных стёкол, окрашенных от светло-жёлтого до оранжевого оттенка.
Абразивные материалы
Диоксид церия — основной компонент полирита, самого эффективного порошка для полирования оптического и зеркального стекла. Полирит — коричневый порошок, состоящий из оксидов редкоземельных элементов. Оксида церия в нём не меньше 45%. Известно, что с переходом на полирит качество полировки значительно улучшилось. На Харьковском заводе имени Ф. Э. Дзержинского, например, выход первосортного зеркального стекла после перехода на полирит увеличился в 10 раз. Выросла и производительность конвейера — за то же время полирит снимает примерно вдвое больше материала, чем другие полирующие порошки.
Пирофорные сплавы
Сплав церия с 50 % железа (ферроцерий), а иногда и мишметалл используется как искусственный «кремень» в зажигалках.
Источники света
Трифторид церия используется в качестве добавки при изготовлении углей для дуговых источников света, его добавление к материалу углей резко повышает яркость свечения.
Огнеупорные материалы
В качестве чрезвычайно стойких огнеупорных материалов используют диоксид церия (до 2300 °C в окислительной и инертной атмосфере), сульфид церия (до 1800 °C в восстановительной атмосфере).
Церий в медицине
Соли церия применяются для лечения и предотвращения симптомов «морской болезни». В стоматологии используется цериевая сталь и керамика с содержанием диоксида церия.
Топливные элементы
Диоксид церия применяется в качестве компонента для производства твёрдого электролита[8] высокотемпературных топливных элементов.
Химические источники тока
Трифторид церия в сплаве с фторидом стронция используется для производства очень мощных твердотельных аккумуляторных батарей. Анодом в таких батареях является чистый металлический церий.
Сварка
Легирующая добавка к электродам с серым наконечником для сварки TIG
Изотопы
Природный церий состоит из смеси четырёх стабильных[9] изотопов: 136Ce (0,185 %), 138Ce (0,251 %), 140Ce (88,450 %) и 142Ce (11,114 %). Два из них (136Ce и 142Ce), в принципе, могут испытывать двойной бета-распад, однако их радиоактивность не наблюдалась, установлены лишь нижние ограничения на периоды полураспада (3,8⋅1016 лет и 5,0⋅1016 лет, соответственно). Известны также 26 радионуклидов церия. Из них наиболее стабильны 144Ce (период полураспада 284,893 д), 139Ce (137,640 д) и 141Ce (32,501 д). Остальные известные радионуклиды церия имеют периоды полураспада менее 4 дней, а большинство из них — менее 10 минут. Известны также 2 изомерных состояния изотопов церия.
Церий-144 (период полураспада — 285 суток) является одним из продуктов деления урана-235, в связи с чем нарабатывается в больших количествах в ядерных реакторах. Применяется в виде диоксида (плотность около 6,4 г/см³) в производстве радиоизотопных источников тока в качестве источника тепла, его энерговыделение составляет около 12,5 Вт/см³.
Токсичность
Оказывает токсическое действие на рыб и низшие водные организмы. Обладает способностью к биоаккумуляции. Рекомендованные ВОЗ ПДК церия для питьевой воды составляют 0—0,05 мг/л.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Atomic Reference Data for Electronic Structure Calculations, Cerium Архивная копия от 20 октября 2020 на Wayback Machine. NIST.gov.
- ↑ Химическая энциклопедия: в 5 тт. / Редкол.:Зефиров Н. С. (гл. ред.). — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 351.
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- ↑ Евдокимов И. Н. Методы и средства исследований. Часть 1. Температура, с. 53. Рос. гос. ун-т нефти и газа им. И. М. Губкина. Дата обращения: 26 февраля 2015. Архивировано 5 марта 2016 года.
- ↑ Магнитная термометрия. БСЭ (3-е изд.), 1974, т. 15. Дата обращения: 26 февраля 2015. Архивировано 27 февраля 2015 года.
- ↑ Абрагам А., Блини Б., Электронный парамагнитный резонанс переходных ионов, т. 1, 1972, с. 361.
- ↑ Применение серосодержащих топлив для прямоокислительных топливных элементов. Дата обращения: 29 июля 2019. Архивировано 29 июля 2019 года.
- ↑ Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — .

Литература
- Абрагам А., Блини Б. Электронный парамагнитный резонанс переходных ионов. Том I. — М.: Мир, 1972. — 652 с.