Цитохром P450
| Цитохром P450 | |
|---|---|
 Молекула цитохрома P450eryF | |
| Обозначения | |
| Символы | CYP |
| CAS | 9035-51-2 |
Цитохром P450 (цитохром P450-зависимая монооксигеназа, англ. cytochrome P450, CYP) — общее название ферментов семейства P450. Входят в класс гемопротеинов, относятся к цитохромам типа b[англ.][1]. Цитохром P450, связанный с монооксидом углерода, имеет максимум поглощения света при длине волны 450 нм, что определило его название[1][2].
Цитохромы P450 обнаружены во всех без исключения царствах живых существ — у животных, растений, грибов, бактерий, архей[3]. Эти белки отсутствуют только у облигатно анаэробных организмов[3]. Описано около 11 500 белков системы CYP. P450 бактерий и архей растворён в цитоплазме, в эволюционном смысле это наиболее древняя форма цитохрома P450. У эукариотических организмов P450 являются мембранными белками[3].
Система цитохрома P450 участвует в окислении многочисленных соединений, как эндогенных, так и экзогенных. Ферменты этой группы играют важную роль в обмене стероидов, желчных кислот, ненасыщенных жирных кислот, фенольных метаболитов, а также в нейтрализации ксенобиотиков (лекарств, ядов, наркотиков)[1][2][4].
Реакции с участием системы цитохрома P450
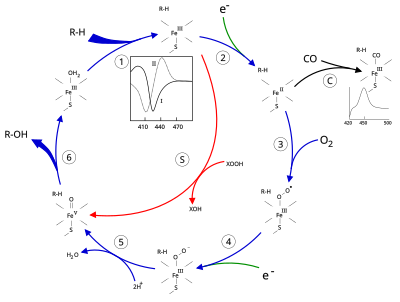
Цитохром Р450-зависимые монооксигеназы катализируют расщепление различных веществ посредством гидроксилирования[англ.] с участием донора электрона НАДФН и молекулярного кислорода. В этой реакции один атом кислорода присоединяется к субстрату, а второй восстанавливается до воды[1][2].
Ферменты семейства цитохрома P450, в отличие от остальных гемопротеинов, как правило, обладающих одним типом активности и строго определённой функцией, достаточно разнообразны по функциям, типам ферментативной активности, зачастую обладают малой субстратной специфичностью. P450 могут проявлять как монооксигеназную, так и оксигеназную активность, поэтому иногда относятся к оксидазам со смешанной функцией[1][4].
Оксигеназные реакции, катализируемые цитохромом Р450, весьма разнообразны. Одна из самых распространённых реакций окисления ксенобиотиков — окислительное деалкилирование, сопровождающееся окислением алкильной группы, присоединённой к атомам N, O или S. Этот процесс происходит в эндоплазматическом ретикулуме (ЭПР) гепатоцитов. Их субстратная специфичность невелика. Они наиболее эффективно катализирует окисление неполярных соединений с алифатическими или ароматическими кольцами. P450 печени, помимо прочего, участвует в окислении спиртов до соответствующих альдегидов. Гидроксилирование гидрофобных соединений улучшает их растворимость в воде и способствует выведению через почки. У разных людей набор цитохромов Р450 в ЭПР различается в силу генетических особенностей. В связи с этим изучение ферментативной системы Р450 имеет большое значение для фармакологии[2][3]. Все другие ферменты семейства Р450 локализованы на внутренней митохондриальной мембране, и их каталитические центры обращены в сторону матрикса[5].
Другой распространённый тип реакций — гидроксилирование циклических соединений (ароматических, предельных и гетероциклических углеводородов). Ферменты семейства Р450 могут также катализировать реакции гидроксилирования алифатических соединений, N-окисление, окислительное дезаминирование, реакции восстановления нитросоединений[2][4].
Цитохромы P450 катализируют омега-окисление насыщенных жирных кислот, перекисное окисление ненасыщенных жирных кислот, гидроксилирование стероидных гормонов, желчных кислот и холестерина, биосинтез простагландинов и витамина D[2][4]. Стероидогенные клетки содержат митохондрии, специализирующиеся на синтезе стероидов. Такие митохондрии обычно крупнее митохондрий клеток других тканей и имеют более развитую и извитую поверхность внутренней мембраны[5].
Гены цитохрома P450 человека
У человека выявлено 57 генов и более 59 псевдогенов системы цитохрома P450. Они подразделяются на 18 семейств и 43 подсемейства. В таблице ниже номенклатура генов цитохромов P450 человека описана более подробно[6].
| Семейство | Функции | Состав | Названия |
| CYP1 | метаболизм лекарств и стероидов (особенно эстрогена) | 3 подсемейства, 3 гена, 1 псевдоген | CYP1A1, CYP1A2, CYP1B1 |
| CYP2 | метаболизм лекарств и стероидов | 13 подсемейств, 16 генов, 16 псевдогенов | CYP2A6, CYP2A7, CYP2A13, CYP2B6, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2D6, CYP2E1, CYP2F1, CYP2J2, CYP2R1, CYP2S1, CYP2U1, CYP2W1 |
| CYP3 | метаболизм лекарств и стероидов (включая тестостерон) | 1 подсемейство, 4 гена, 2 псевдогена | CYP3A4, CYP3A5, CYP3A7, CYP3A43 |
| CYP4 | метаболизм арахидоновой кислоты | 6 подсемейств, 12 генов, 10 псевдогенов | CYP4A11, CYP4A22, CYP4B1, CYP4F2, CYP4F3, CYP4F8, CYP4F11, CYP4F12, CYP4F22, CYP4V2, CYP4X1, CYP4Z1 |
| CYP5 | синтез тромбоксана A2 | 1 подсемейство, 1 ген | CYP5A1 (синтаза тромбоксана A2) |
| CYP7 | биосинтез желчных кислот, участие в метаболизме стероидов | 2 подсемейства, 2 гена | CYP7A1, CYP7B1 |
| CYP8 | различные | 2 подсемейства, 2 гена | CYP8A1 (синтез простациклина), CYP8B1 (биосинтез желчных кислот) |
| CYP11 | биосинтез стероидов | 2 подсемейства, 3 гена | CYP11A1, CYP11B1, CYP11B2 |
| CYP17 | биосинтез стероидов, 17-альфа гидроксилаза | 1 подсемейство, 1 ген | CYP17A1 |
| CYP19 | биосинтез стероидов (ароматаза, синтезирующая эстроген) | 1 подсемейство, 1 ген | CYP19A1 |
| CYP20 | не установлены | 1 подсемейство, 1 ген | CYP20A1 |
| CYP21 | биосинтез стероидов | 2 подсемейства, 1 ген, 1 псевдоген | CYP21A2 |
| CYP24 | биодеградация витамина D | 1 подсемейство, 1 ген | CYP24A1 |
| CYP26 | гидроксилирование ретиноловой кислоты | 3 подсемейства, 3 гена | CYP26A1, CYP26B1, CYP26C1 |
| CYP27 | различные | 3 подсемейства, 3 гена | CYP27A1 (биосинтез желчных кислот), CYP27B1 (1-альфа-гидроксилаза витамин D3, активирующая витамин D3), CYP27C1 (функция не установлена) |
| CYP39 | 7-альфа-гидроксилирование 24-гидроксихолестерола | 1 подсемейство, 1 ген | CYP39A1 |
| CYP46 | холестерол 24-гидроксилаза | 1 подсемейство, 1 ген | CYP46A1 |
| CYP51 | биосинтез холестерола | 1 подсемейство, 1 ген, 3 псевдогена | CYP51A1 (14-альфа деметилаза[англ.] ланостерола) |
Примечания
- ↑ 1 2 3 4 5 Бриттон, 1986, с. 180—181.
- ↑ 1 2 3 4 5 6 Кольман, Рем, 2000, с. 310—311.
- ↑ 1 2 3 4 Danielson P. B. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans. (англ.) // Current drug metabolism. — 2002. — Vol. 3, no. 6. — P. 561—597. — PMID 12369887.
- ↑ 1 2 3 4 Ortiz de Montellano, Paul R. Cytochrome P450: structure, mechanism, and biochemistry. — 3rd edition. — New York: Kluwer Academic/Plenum Publishers, 2005. — ISBN 0-306-48324-6.
- ↑ 1 2 Нельсон, Кокс, 2014, с. 348—349.
- ↑ Nelson, DR. The Cytochrome P450 Homepage. Дата обращения: 14 октября 2010. Архивировано из оригинала 27 июня 2010 года.
Литература
- Нельсон, Д. Основы биохимии Ленинджера : в 3 т. / Д. Нельсон, М. Кокс. — М. : БИНОМ, 2014. — Т. 2. — С. 348—349. — 636 с. — ISBN 978-5-94774-366-1.
- Бриттон, Г. 5.5.9. Цитохром P450 // Биохимия природных пигментов = Britton, G. The Biochemistry of Natural Pigments : [англ.]. — Cambridge University Press, 1983. / Пер. с англ. канд. биол. наук В. Д. Цыдендембаева; под ред. проф. М. Н. Запрометова. — М. : Мир, 1986. — С. 180–181. — 422 с. : ил. — 3050 экз. — ББК 28.072. — УДК 577.117.3(G).
- Кольман, Ян. [yanko.lib.ru/books/biolog/nagl_biochem/ Наглядная биохимия] = Taschenatlas der Biochemie : [пер. с нем.] / Ян Кольман, Клаус-Генрих Рем. — М. : Мир, 2000. — 470 с. — 7000 экз.
- Пономаренко, Т. М. Система цитохрома Р450 в лёгких: роль в патогенезе заболеваний и фармакокинетике лекарственных средств / Т. М. Пономаренко, Д. А. Сычёв, А. О. Чикало … [и др.] // Фармакокинетика и Фармакодинамика. — 2012. — № 1. — С. 25—28.
- Каталитический конвертер : новые области применения знаний о цитохроме Р450 = Catalytic converter : harnessing the P450 : [англ.] // Scrip[англ.]. — 2003. — April. — P. 9–11. // Антибиотики и антимикробная терапия. — 2003. — 6 мая.
Ссылки
- Арчаков, А. И. P450 цитохромы / А. И. Арчаков, И. И. Карузина // База знаний по биологии человека.
- Цитохром P450. Радость здоровья — сила красоты.










