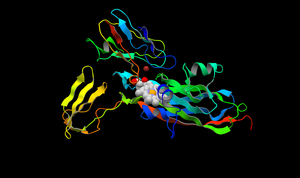
Цитохром — небольшой гем-содержащий белок, относится к классу цитохромов, содержит в структуре гем типа c. Выполняет в клетке две функции. С одной стороны, он является одноэлектронным переносчиком, свободно связанным с внутренней мембраной митохондрий, и необходимым компонентом дыхательной цепи. Он способен окисляться и восстанавливаться, но не связывает при этом кислород. С другой стороны, при определённых условиях он может отсоединяться от мембраны, переходить в раствор в межмембранном пространстве и активировать апоптоз. Такая двойственность связана со специфичными свойствами молекулы цитохрома c.
Цитохромы (гемопротеины) — это крупные мембранные белки, которые содержат ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками.
Дыхательная цепь переноса электронов, также электрон-транспортная цепь (сокр. ЭТЦ, англ. ETC, Electron transport chain) — система трансмембранных белков и переносчиков электронов, необходимых для поддержания энергетического баланса. ЭТЦ поддерживает баланс за счёт переноса электронов и протонов из НАД∙Н и ФАДН2 в акцептор электронов. В случае аэробного дыхания акцептором может быть молекулярный кислород (О2). В случае анаэробного дыхания акцептором могут быть NO3−, NO2−, Fe3+, фумарат, диметилсульфоксид, сера, SO42−, CO2 и т. д. ЭТЦ у прокариот локализована в ЦПМ, у эукариот — на внутренней мембране митохондрий. Переносчики электронов расположены в порядке уменьшения сродства к электрону, то есть по своему окислительно-восстановительному потенциалу, где у акцептора самое сильное сродство к электрону. Поэтому транспорт электрона на всём протяжении цепи протекает самопроизвольно с выделением энергии. Выделение энергии в межмембранное пространство при переносе электронов происходит ступенчато, в виде протона (H+). Протоны из межмембранного пространства попадают в протонную помпу, где наводят протонный потенциал. Протонный потенциал преобразуется АТФ-синтазой в энергию химических связей АТФ. Сопряжённая работа ЭТЦ и АТФ-синтазы носит название окислительного фосфорилирования.

Окисли́тельное фосфорили́рование — метаболический путь, при котором энергия, образовавшаяся при окислении питательных веществ, запасается в митохондриях клеток в виде АТФ. Хотя различные формы жизни на Земле используют разные питательные вещества, АТФ является универсальным соединением, в котором запасается энергия, необходимая для других метаболических процессов. Почти все аэробные организмы осуществляют окислительное фосфорилирование. Вероятно, широкому распространению этого метаболического пути способствовала его высокая энергетическая эффективность по сравнению с анаэробным брожением.
Кардиолипин — фосфолипид, который является важным компонентом внутренней мембраны митохондрий, липидный состав которой включает около 20 % кардиолипина. Кардиолипин во внутренней мембране митохондрий клеток млекопитающих и растительных клеток необходим для функционирования многочисленных ферментов, участвующих в энергетическом обмене. Кардиолипин также встречается в мембранах бактерий.

Цитохром-c-оксида́за (цитохромоксидаза) или цитохром-c-кислород:оксидоредуктаза, также известная как цитохром aa3 и комплекс IV — терминальная оксидаза аэробной дыхательной цепи переноса электронов, которая катализирует перенос электронов с цитохрома с на кислород с образованием воды. Цитохромоксидаза присутствует во внутренней мембране митохондрий всех эукариот, где её принято называть комплекс IV, а также в клеточной мембране многих аэробных бактерий.

Цитохром b-245, альфа-полипептид, или p22-phox — трансмембранный белок, субъединица цитохрома b, состоящего из лёгкой цепи (альфа) и тяжёлой цепи (бета). Ген CYBA кодирует лёгкую альфа-субъединицу, необходимый компонент практически всех NADPH-оксидаз. Образует гетеродимер с тяжёлой цепью цитохрома, основным каталитическим компонентом NADPH-оксидаз, требующих, однако, для активации взаимодействия с несколькими регуляторными белками. Играет роль в продукции супероксидов и фагоцитозе.

Цитохром P450 3A4 (сокращённо CYP3A4) — один из наиболее важных ферментов, участвующих в метаболизме ксенобиотиков в организме человека, в основном находится в печени и кишечнике. Его целью является окисление небольших чужеродных органических молекул, таких как токсины или лекарства, с тем, чтобы их можно было вывести из организма. У людей бело́к CYP3A4 кодируется ге́ном CYP3A4. Этот ген является частью кластера генов цитохрома P450 на хромосоме 7q21.1.

Гем С — вид гема, отличается от гема B наличием тиольных групп.

Гем а — вид гема, координационный комплекс макроциклического лиганда порфирина и атома железа.
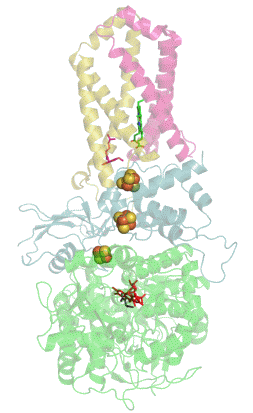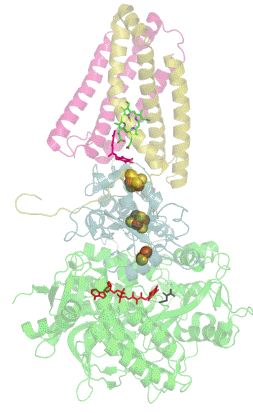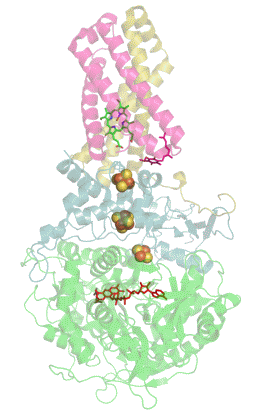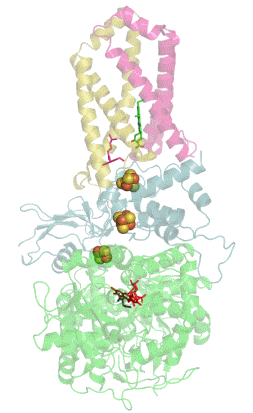
Сукцинатдегидрогеназа или сукцинат-убихинон-оксидорекдуктаза, также известная как комплекс II — белковый комплекс, расположенный во внутренней мембране митохондрий и мембранах многих прокариотических организмов. Одновременно участвует в цикле трикарбоновых кислот и дыхательной цепи переноса электронов.
Ферредокси́ны — группа небольших растворимых белков, содержащих железосерные кластеры и являющихся подвижными переносчиками электронов в ряде метаболических процессов. Обычно они переносят один или два электрона за счёт изменения окисленности атомов железа.

Фотосисте́ма I, или пластоциани́н-ферредокси́н-оксидоредукта́за — второй функциональный комплекс электрон-транспортной цепи (ЭТЦ) хлоропластов. Он принимает электрон от пластоцианина и, поглощая световую энергию, формирует сильный восстановитель П700, способный через цепь переносчиков электронов осуществить восстановление НАДФ+. Таким образом, при участии ФСI синтезируется источник электронов (НАДФН) для последующих реакций восстановления углерода в хлоропластах в цикле Кальвина. Кроме того, ФСI может осуществлять циклический транспорт электронов, сопряжённый с синтезом АТФ, обеспечивая дополнительный синтез АТФ в хлоропластах.

Пластоцианин — медьсодержащий белок, вовлечённый в транспорт электронов от фотосистемы II к фотосистеме I. Этот мономерный белок, состоящий у большинства сосудистых растений из 99 аминокислот, имеет молекулярную массу около 10,5 кДа. Он является представителем пластоцианинового семейства медьсвязывающих белков.

Цитохро́м-b6f-ко́мплекс, или пластохинолпластоцианинредукта́за — мультибелковый комплекс, который осуществляет окисление пластохинолов и восстановление белка пластоцианина, обеспечивая, таким образом, транспорт электронов между реакционными центрами фотосистемы I (ФСI) и фотосистемы II (ФСII). Он восстанавливает маленький водорастворимый белок пластоцианин, который переносит электрон к ФСII. Аналогичную реакцию катализирует цитохром-bc1-комплекс электрон-транспортной цепи митохондрий. Цитохром-b6f-комплекс присутствует в тилакоидной мембране хлоропластов растений, водорослей и цианобактерий. Он функционально объединяет две фотосистемы в единую цепь переноса электронов от воды к НАДФ+, то есть является участником нециклического потока электронов. Кроме того, цитохромный комплекс вовлечён в циклический транспорт электронов, осуществляемый фотосистемой I.

Цитохро́м-bс1-ко́мплекс или убихинол-цитохром с-оксидоредуктаза, или комплекс III — мультибелковый комплекс дыхательной цепи переноса электронов и важнейший биохимический генератор протонного градиента на мембране митохондрий. Этот мультибелковый трансмембранный комплекс кодируется митохондриальным и ядерным геномами.

Миксотиазол — ингибитор митохондриального фермента цитохром-bc1-комплекса. Блокирует транспорт электронов и подавляет клеточное дыхание.

Фотофосфорили́рование — процесс синтеза АТФ из АДФ за счёт энергии света. Как и в случае окислительного фосфорилирования, энергия света расходуется на создание протонного градиента на мембране тилакоидов или клеточной мембране бактерии, который затем используется АТФ-синтазой. Фотофосфорилирование — очень древняя форма фотосинтеза, которая есть у всех фототрофных эукариот, бактерий и архей. Различают два типа фосфорилирования — циклическое, сопряжённое с циклическим потоком электронов в электрон-транспортной цепи, и нециклическое, сопряжённое с прямым потоком электронов от H2O к НАДФ+ в случае эукариот или другого донора электрона в случае бактерий, например, H2S. Как разновидность нециклического типа выделяют псевдоциклическое фотофосфорилирование, при котором акцептором электронов служит кислород.
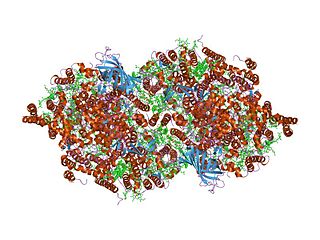
Цитохром b559 — гетеродимерный белок, состоящий из одной альфа (PsbE) и одной бета (PsbF) субъединицы, между которыми расположен гем; важный компонент фотосистемы II.

Феррохелатаза, также протопорфирин феррохелатаза или протогем ферро-лиаза (протопорфиринобразующая) — фермент (КФ 4.98.1.1 ) из класса лиаз, который катализирует последнюю (8-ю) реакцию биосинтеза гема — превращение молекул протопорфирина IX в гем Б. У человека фермент кодируется геном FECH, локализованный на коротком плече (p-плече) 18-й хромосомы. Реакция, катализируемая данным ферментом:
- протогем (гем Б) + 2H+ = протопорфирин IX + Fe+2.