Протео́мика — область молекулярной биологии, посвящённая идентификации и количественному анализу белков. Термин «протеомика» был предложен в 1997 году. Совокупность всех белков клетки называют протеомом.

Ферме́нты, или энзи́мы , — обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.

Митохо́ндрия — двумембранная сферическая или эллипсоидная органелла диаметром обычно около 1 микрометра. Характерна для большинства эукариотических клеток, как автотрофов, так и гетеротрофов. Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии для генерации электрического потенциала, синтеза АТФ и термогенеза. Эти три процесса осуществляются за счёт движения электронов по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют. В специализированных клетках органов животных содержатся сотни и даже тысячи митохондрий.

Рибосо́ма — важнейшая немембранная органелла всех живых клеток, служащая для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК (мРНК). Этот процесс называется трансляцией. Рибосомы имеют сферическую или слегка эллипсоидную форму, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоят из большой и малой субъединиц. Малая субъединица считывает информацию с матричной РНК, а большая — присоединяет соответствующую аминокислоту к синтезируемой цепочке белка.

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например, фотосинтетический комплекс и другие комплексы.
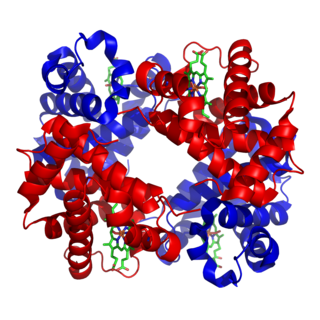
Глобулярные белки́ — белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры — глобулы.

Денатурация белков — изменение нативной конформации белковой молекулы под действием различных дестабилизирующих факторов. Аминокислотная последовательность белка не изменяется. Приводит к потере белками их естественных свойств.

Мы́шцы, также му́скулы — органы, состоящие из мышечной ткани; способны сокращаться под влиянием нервных импульсов. Часть опорно-двигательного аппарата. Выполняют различные движения, обеспечивая перемещение тела, поддержание позы, сокращение голосовых связок, дыхание и прочее. Мышечная ткань — упруга и эластична; состоит из миоцитов. Для мышц характерно утомление, которое проявляется при интенсивной работе или нагрузке.
Биополиме́ры — класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды, лигнин. Биополимеры состоят из одинаковых звеньев — мономеров. Мономеры белков — аминокислоты, нуклеиновых кислот — нуклеотиды, в полисахаридах — моносахариды.
Фибрин — высокомолекулярный, неглобулярный белок, образующийся из фибриногена, синтезируемого в печени, в плазме крови под действием фермента тромбина; имеет форму гладких или поперечноисчерченных волокон, сгустки которых составляют основу тромба при свёртывании крови.

Нуклеи́новая кислота — высокомолекулярное органическое соединение, биополимер (полинуклеотид), образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
Коллаге́н — гликопротеин, фибриллярный белок, составляющий основу соединительной ткани организма и обеспечивающий её прочность и эластичность. Коллаген обнаружен у животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих, составляющий от 25 % до 45 % белков во всём теле. Синтез коллагена очень энергозатратен и происходит только у животных, которые используют кислород. Появление коллагена позволило создать скелет, как внешний, так и внутренний, и резко увеличить размеры животных во время кембрийского взрыва.

Аденозинтрифосфатсинта́за (АТФ-синта́за, АТФ-фосфогидролаза, H+-transporting two-sector ATPase) — группа ферментов, относящихся к классу транслоказ и синтезирующих аденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганического фосфата. Название по номенклатуре — АТФ-фосфогидролаза, однако с августа 2018 года фермент перенесён из третьего (3.6.3.14) в седьмой класс (7.1.2.2), так как катализируемая ферментом реакция протекает по пути, противоположному гидролизу, и не может быть описана с помощью других типов реакций, характеризующие прочие классы ферментов.

В биохимии и молекулярной биологии фо́лдингом белка называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру.
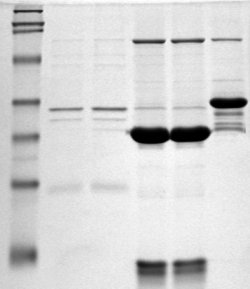
Электрофорез белков в полиакриламидном геле — метод разделения смесей белков в полиакриламидном геле в соответствии с их электрофоретической подвижностью. Данный способ фракционирования белков и пептидов широко применяют в современной молекулярной биологии, биохимии, генетике.

Третичная структура — пространственное строение всей молекулы белка или другой макромолекулы, состоящей из единственной цепи.

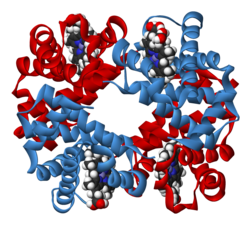
Белковая субъединица в структурной биологии — полипептид, который вместе с другими компонентами собирается в мультимерный или олигомерный белковый комплекс. Многие природные ферменты и другие белки состоят из нескольких белковых субъединиц.

Белок-белковые взаимодействия (ББВ) — обладающие высокой специфичностью физические контакты между двумя и более белками. Эти контакты образуются в результате биохимических событий с помощью электростатических взаимодействий, в том числе гидрофобного эффекта.
В молекулярной биологии и биохимии под термином эффектор, или эффекторная молекула обычно понимают малую небелковую молекулу, которая селективно связывается с теми или иными белками и регулирует их биологическую активность. В этом смысле эффекторные молекулы работают как специфические лиганды, которые могут повышать или снижать активность ферментов, транскрипцию и экспрессию генов, или внутриклеточный либо межклеточный процесс передачи сигнала. Эффекторные молекулы также могут непосредственно регулировать активность некоторых молекул мРНК.

Мультибелковый комплекс представляет собой группу, состоящую из двух или более связанных полипептидных цепей. Различные полипептидные цепи могут иметь разнообразные функции. Мультибелковый комплекс отличается от мультиферментного полипептида, тем, что в последнем многочисленные каталитические домены находятся в одной полипептидной цепи.