Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например, фотосинтетический комплекс и другие комплексы.
Эозинофи́лы — разновидность лейкоцитов, основная функция которых заключается в борьбе с многоклеточными паразитами. Зрелые эозинофилы человека имеют ядро, разделённое на две части (двудольное), и эозинофильные гранулы, содержащие белки с цитотоксическими свойствами. Молекулярными маркерами эозинофилов являются белки CD9 и CD35. У здорового человека эозинофилы составляют от 0,5 % до 5 % от общего числа лейкоцитов.

G-белки — это семейство белков, относящихся к ГТФазам и функционирующих в качестве вторичных посредников во внутриклеточных сигнальных каскадах. G-белки названы так, поскольку в своём сигнальном механизме они используют замену GDP на GTP как молекулярный функциональный «выключатель» для регулировки клеточных процессов.
Кристалли́н — общее название смеси белков, входящих в состав хрусталика глаза человека и других животных. Кристаллин состоит из нескольких индивидуальных белков: у человека α- и β-кристаллины — белки-шапероны, поддерживающие структуру белков хрусталика и, следовательно, его прозрачность. γ- кристаллин — структурный белок хрусталика. Также кристаллины найдены в роговице, где играют ту же роль — обеспечение прозрачности. Эти белки также были обнаружены в других органах и тканях: в сердце и в раковых опухолях молочной железы. Поскольку было установлено, что травма хрусталика может вызвать регенерацию нервов, кристаллин стал областью исследований нейробиологов. Пока удалось показать, что кристаллин β b2 (cryβb2) может способствовать росту нервных волокон.

Факторы транскрипции — белки́, контролирующие процесс синтеза мРНК, а также других видов РНК на матрице ДНК (транскрипцию) путём связывания со специфичными участками ДНК. Транскрипционные факторы выполняют свою функцию либо самостоятельно, либо в комплексе с другими белками. Они обеспечивают снижение (репрессоры) или повышение (активаторы) константы связывания РНК-полимеразы с регуляторными последовательностями регулируемого гена.
Белки теплового шока — это класс функционально сходных белков, экспрессия которых усиливается при повышении температуры или при других стрессирующих клетку условиях.

Молекуля́рный до́кинг — метод молекулярного моделирования, позволяющий предсказать наиболее выгодную для образования устойчивого комплекса ориентацию и конформацию одной молекулы (лиганда) в сайте связывания другой (рецептора). Данные о положении и конформации партнеров используются для предсказания силы взаимодействия посредством так называемых оценочных функций. В случае, если лиганд является макромолекулой, докинг называют макромолекулярным.

Белок-белковые взаимодействия (ББВ) — обладающие высокой специфичностью физические контакты между двумя и более белками. Эти контакты образуются в результате биохимических событий с помощью электростатических взаимодействий, в том числе гидрофобного эффекта.
Белок теплового шока 4 — белок, кодируемый у человека геном HSPA4. Молекулярный вес — 70 кДа.
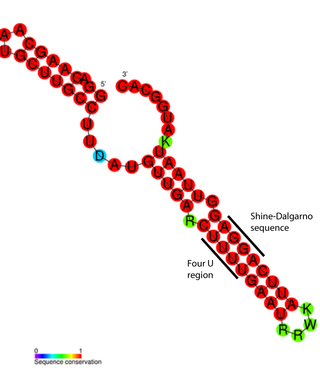
РНК-термо́метр, или РНК-термосе́нсор — температурочувствительная некодирующая РНК, которая принимает участие в регуляции экспрессии генов. РНК-термометры, как правило, регулируют гены, которые необходимы для ответа на тепловой или холодовой шок, однако показано их участие в регуляции длительного голодания и патогенности.

PML-тельца́ — сферические тельца диаметром 0,1—1,0 мкм, имеющиеся в ядрах клеток многих тканей и большинства линий и входящие в состав ядерного матрикса. Ключевой организующий компонент PML-телец — белок PML, который привлекает в PML-тельца множество разнообразных белков, которые объединяет только способность подвергаться сумоилированию. В тельцах PML белки подвергаются посттрансляционным модификациям, которые приводят к изоляции белков в PML-тельцах, активации или деградации. По морфологическим признакам выделяют несколько подтипов PML-телец, причём все они характеризуются наличием электроноплотной оболочки и внутренней коровой части.
Молекулярный фрагмент, ассоциированный с повреждениями (DAMPs), также известный как молекулярный фрагмент, ассоциированный с опасностью, является молекулой, способной инициировать неинфекционный воспалительный ответ. В отличие от этого, патоген-ассоциированный молекулярный фрагмент молекул (PAMPs) инициирует воспалительный ответ на инфекционный возбудитель. Множество белков DAMPs находятся в клеточном ядре и внутриклеточной жидкости. В случае, если они окажутся вне клетки или на её поверхности в результате повреждения тканей, они будут двигаться от восстановительной к окислительной среде, что приводит к их денатурации. Кроме того, после некроза, опухолевая ДНК высвобождается из ядра, и вне клетки становится DAMP.
Нуклеофозми́н — ядрышковый белок, у человека кодируется геном NPM1, локализованным на 5-й хромосоме. Нуклеофозмин перемещается между ядром и цитоплазмой и действует как многофункциональный шаперон нуклеиновых кислот, принимающий участие в таких процессах, как биогенез рибосом, ремоделирование хроматина, регуляция митоза, поддержание стабильности генома, репарация ДНК и транскрипция. Нарушения в работе нуклеофозмина могут приводить к развитию злокачественных новообразований и других заболеваний; в частности, мутации, затрагивающие его ген, приводят к развитию острого миелоидного лейкоза.
SMC-белки — представляют собой большое семейство АТФаз, которые участвуют в регулировании организации структурного порядка хромосом и их динамики.
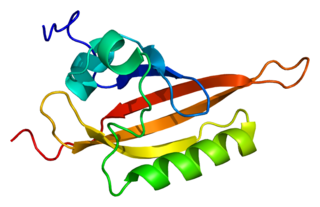
ARNT — ядерный транслокатор (переносчик) рецептора ароматических углеводородов (AHR), представляет собой белок, который образует комплекс с лиганд-связанным рецептором AHR и необходим для рецепторной функции. Кодируется одноимённым геном ARNT, локализован на коротком плече (p-плече) 1-хромосомы.
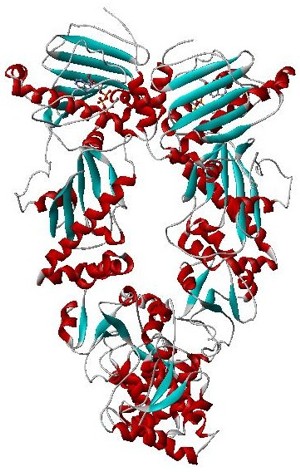
Hsp90, также белок теплового шока 90 — это белок-шаперон, который помогает другим белкам правильно складываться, стабилизирует белки от теплового стресса и способствует деградации белка. Он также стабилизирует ряд белков, необходимых для роста опухоли, поэтому ингибиторы Hsp90 исследуются как противораковые лекарственные средства.
Белки позднего эмбриогенеза (LEA-белки, от англ. Late Embryogenesis Abundant) группа животных и растительных белков, защищающих другие клеточные белки от агрегации при дегидратации или осмотическом стрессе, связанном с низкими температурами.
Макромолекулярный докинг — это метод молекулярного моделирования четвертичной структуры комплексов, образованных двумя или более взаимодействующими биологическими макромолекулами. Чаще всего исследуются белок-белковые комплексы, реже — белок-нуклеиновые.

Сериновая/треониновая протеинкиназа/эндорибонуклеаза Инозитол-требующий фермент 1 α (IRE1α) — это фермент, который у человека кодируется геном ERN1.

Совместительство белков — это явление, при котором белок может выполнять более одной функции. Белки предков, работающие по совместительству, изначально обладали одной функцией, но в процессе эволюции приобрели дополнительные функции. Многие из этих белков являются ферментами; другие являются рецепторами, ионными каналами или шаперонами. Наиболее распространенной основной функцией подрабатывающих белков является ферментативный катализ, но эти ферменты приобрели вторичные неферментативные роли. Некоторые примеры функций подрабатывающих белков, вторичных по отношению к катализу, включают передачу сигнала, регуляцию транскрипции, апоптоз, подвижность и структурную деятельность.