Шпилька (биология)

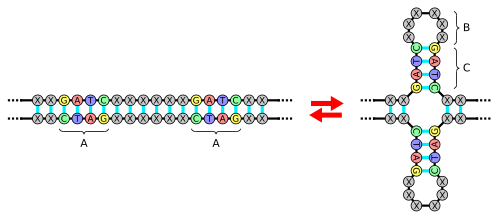
Шпи́лька (англ. stem-loop, hairpin) — в молекулярной биологии элемент вторичной структуры РНК, а также одноцепочечной ДНК. Шпилька образуется в том случае, когда две последовательности одной и той же цепи комплементарны друг другу и соединяются друг с другом, перегибаясь одна к другой и образуя на конце неспаренный участок — петлю. Такие комплементарные последовательности нередко представляют собой палиндромные последовательности[англ.].
У некоторых видов РНК шпильки имеют важное функциональное значение (подробнее см. ниже).
Образование и стабилизация
Образование шпильки определяется тем, будет ли стабильной образовавшаяся структура, а именно — стебель и петля. Для первого ключевое условие — наличие последовательности, которая, образуя водородные связи сама с собой, формирует стабильную двойную спираль. Стабильность спирали определяется её длиной, а также числом неспарившихся оснований и, как следствие, образовавшихся «выпуклостей» (небольшое их число допускается, особенно для длинной спирали), а также составом спаренных оснований. Гуанин и цитозин связываются друг с другом тремя водородными связями, отчего их соединение более стабильно, чем аденина с урацилом, обеспечиваемое двумя водородными связями. В РНК пары гуанин—урацил стабилизируются двумя водородными связями и также являются, наряду с уотсон-криковскими парами, вполне допустимыми. Стэкинг-взаимодействия азотистых оснований, обусловленные пи-связями между циклическими элементами оснований, располагают основания в правильной ориентации и тем самым стимулируют формирование спирали.
Своё влияние на образование шпильки также оказывает стабильность формирующейся при этом петли. Петли, содержащие 3 или менее основания, пространственно[англ.] невозможны и не формируются. Слишком крупные петли, не имеющие собственной вторичной структуры (например, псевдоузлов), также нестабильны. Оптимальная длина петли составляет 4—8 нуклеотидов. Часто встречающаяся петля с последовательностью UUCG, известная как тетрапетля[англ.], частично стабильна благодаря стэкинг-взаимодействиям составляющих её нуклеотидов.
Биологическая роль
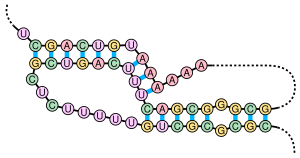
Наиболее известна роль шпилек в тРНК. тРНК содержит 3 истинные шпильки с общим стеблем и за счёт этого имеющая форму клеверного листа[1]. Антикодон, распознающий соответствующий кодон мРНК во время трансляции, располагается на одной из петель. Встречаются шпильки и в микроРНК[2]. Образование шпилек напрямую связано с образованием псевдоузлов — ещё одним элементом вторичной структуры РНК.
Шпильковые структуры выявлены у многих рибозимов[3][4]. Самовырезающийся рибозим типа hammerhead содержит 3 шпильки в центральном неспаренном регионе, где и находятся сайты вырезания.
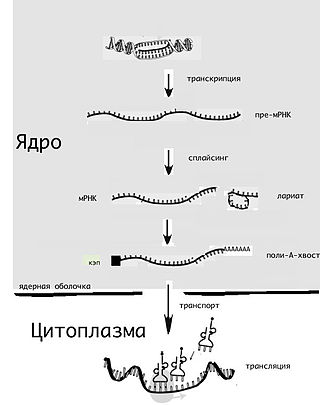
Шпильки часто встречаются в 5'-нетранслируемой области прокариот. Эти структуры нередко связываются с белками и отвечают за аттенюацию, тем самым участвуя в регуляции транскрипции[5].
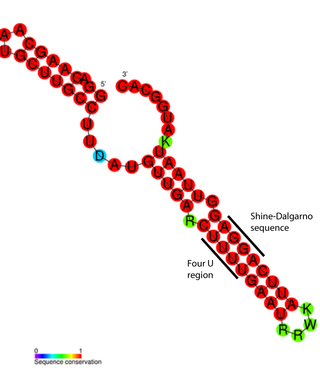
В мРНК шпилька образует сайт связывания рибосомы[англ.], задействованный в инициации трансляции[6][7].
Шпильки также важны в прокариотической ρ-независимой терминации транскрипции[англ.]. В ходе транскрипции образуется шпилька, которая заставляет РНК-полимеразу оторваться от ДНК-матрицы. Этот процесс и называется ρ-независимой терминацией транскрипции, а задействованные в этом последовательности называются терминаторными[8].
См. также
Примечания
- ↑ Коничев, Севастьянова, 2012, с. 104.
- ↑ Okamura K, Ladewig E, Zhou L, Lai EC. Functional small RNAs are generated from select miRNA hairpin loops in flies and mammals. // Genes Dev.. — 2013. — Т. 27, № 7. — С. 778—792. — doi:10.1101/gad.211698.112..
- ↑ Ferre-D'amare, AR; Rupert P. B. The hairpin ribozyme: from crystal structure to function (англ.) // Biochem Soc Trans[англ.] : journal. — 2002. — Vol. 30. — P. 1105—1109. — doi:10.1042/BST0301105. — PMID 12440983.
- ↑ Doherty, EA; Doudna J. A. Ribozyme structures and mechanisms (англ.) // Annu Rev Biophys Biomol Struct : journal. — 2001. — Vol. 30. — P. 457—475. — doi:10.1146/annurev.biophys.30.1.457. — PMID 11441810.
- ↑ Meyer, Michelle; Deiorio-Haggar K., Anthony J. RNA structures regulating ribosomal protein biosynthesis in bacilli (англ.) // RNA BIology : journal. — 2013. — July (vol. 7). — P. 1160—1164. — doi:10.4161/rna.24151. — PMID 23611891. Архивировано 8 ноября 2016 года.
- ↑ Malys N., Nivinskas R. Non-canonical RNA arrangement in T4-even phages: accommodated ribosome binding site at the gene 26-25 intercistronic junction (англ.) // Microbiology[англ.] : journal. — Microbiology Society[англ.], 2009. — Vol. 73, no. 6. — P. 1115—1127. — doi:10.1111/j.1365-2958.2009.06840.x. — PMID 19708923.
- ↑ Malys N., McCarthy JEG. Translation initiation: variations in the mechanism can be anticipated (англ.) // Cellular and Molecular Life Sciences : journal. — 2010. — Vol. 68, no. 6. — P. 991—1003. — doi:10.1007/s00018-010-0588-z. — PMID 21076851.
- ↑ Wilson K. S., von Hippel P. H. Transcription termination at intrinsic terminators: the role of the RNA hairpin (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1995. — September (vol. 92, no. 19). — P. 8793—8797. — doi:10.1073/pnas.92.19.8793. — PMID 7568019. — PMC 41053.
Литература
- Коничев А. С., Севастьянова Г. А. Молекулярная биология. — Издательский центр «Академия», 2012. — 400 с. — ISBN 978-5-7695-9147-1.
- Watson JD, Baker TA, Bell SP, Gann A, Levine M, Losick R. (2004). Molecular Biology of the Gene. 5th ed. Pearson Benjamin Cummings: CSHL Press. See esp. ch. 6.