Щелочной элемент

Щелочной элемент питания, щелочная батарейка (англ. alkaline battery; также в просторечии неграмотно алкалиновая батарейка, калька с английского языка) — марганцево-цинковый гальванический элемент питания с щелочным электролитом. Изобретён Льюисом Урри[1].
Кроме электролита, основное отличие щелочной батарейки от солевой — анод (отрицательный электрод[2]) в виде порошка, что увеличивает ток, отдаваемый этим элементом питания[1].
У стандартных элементов питания с щелочным электролитом анод состоит из цинка, а материалом катода может быть двуокись марганца, оксид серебра, кислород или метагидроксид никеля[3].
История изобретения
Впервые использовать щелочной электролит в химических источниках тока предложили независимо друг от друга Вальдемар Джангнер[англ.] в 1899 году и Томас Эдисон в 1901 году[4][5]. Они использовали щелочной электролит в никель-кадмиевых аккумуляторах.[]
В марганцево-цинковых элементах питания щелочной электролит впервые применил канадский инженер Льюис Урри[англ.] в середине 1950-х годов, работавший в Union Carbide, выпускавшей элементы питания под маркой «Eveready». Льюис Урри использовал наработки Томаса Эдисона[6]. В 1960 году Урри вместе с Карлом Кордешем и Полом Маршалом получил патент на конструкцию щелочного элемента[7].
Классификация
Щелочные элементы выпускаются в двух основных вариантах[8][9]:
- щелочной элемент питания (англ. Alkaline), масса таких элементов AA находится в пределах 22–24 г, ёмкость 2–3 Вт·ч, а масса и ёмкость элементов AAA — 11–12 г и 0,9–1,3 А·ч[8], ёмкость таких элементов одинакового типоразмера отличается не более, чем на треть[9];
- экономичный щелочной элемент питания (англ. ECO Alkaline) со сниженным количеством химикатов и приблизительно вдвое-втрое меньшей ёмкостью относительно обычных того же типоразмера, элементы «ECO Alkaline» типоразмера AA имеют массу около 18 г[9].
Характеристики
Типичные характеристики щелочного элемента питания:
- напряжение холостого хода: 1,58–1,64 В[8].
- начальное напряжение: 1,4–1,64 В[10];
- конечное напряжение: 0,7–0,9 В[10];
- удельная энергия: 60–90 Вт∙ч/кг[11][10];
- удельная мощность (ориентировочно): 5 Вт/кг[11];
- рабочая температура: −20…+70 °С[12];
- сохранность: 1–3 года[11]
Химические процессы
Гидроксид калия (KOH) диссоциирует на ионы:
Затем на аноде щелочного элемента питания проходят реакции окисления цинка.
На катоде, в свою очередь, происходят реакции восстановления оксида марганца (IV) в оксид марганца (III)[13]:
В целом, химические процессы внутри элемента при использовании KOH в качестве электролита можно описать следующим уравнением[14]:
При саморазряде батареи возможна реакция KOH и ZnO:
, но она незначительна. Поэтому в отличие от солевого элемента, в щелочном электролит в процессе разрядки батареи практически не расходуется, а значит, достаточно малого его количества. Поэтому в щелочном элементе в среднем в 1,5 раза больше диоксида марганца.
Конструкция
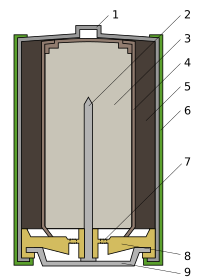
По конструкции щелочной элемент похож на солевой, но основные части в нём расположены в обратном порядке[14]. Анодная паста (3) в виде цинкового порошка, пропитанного загущённым щелочным электролитом, располагается во внутренней части элемента и имеет отрицательный потенциал, который снимается латунным стержнем (2). От активной массы, диоксида марганца, смешанного с графитом или сажей (5), анодная паста отделена сепаратором (4), также пропитанным электролитом. Положительный вывод, в отличие от солевого элемента, выполнен в виде стального никелированного стакана (1), а отрицательный — в виде стальной тарелки (9).[14] Оболочка (6) изолирована от стакана и предотвращает короткое замыкание, которое может возникнуть при установке нескольких элементов в батарейный отсек[15]. Прокладка (8) воспринимает давление газов, образующихся при работе. Выделение газов в щелочном элементе значительно меньше, чем в солевом, поэтому объём камеры для их сбора тоже меньше. Для предотвращения взрыва батареи при неправильном использовании (например, коротком замыкании), в ней имеется предохранительная мембрана (7). При превышении давления газов происходит разрыв мембраны и разгерметизация элемента — результатом обычно становится течь электролита.
Для увеличения срока хранения в ранних конструкциях элементов производилось амальгамирование цинкового порошка[16], однако такой способ продления срока хранения элементов делает элементы опасными для использования в быту. Поэтому в современные элементы вводят специальные органические ингибиторы коррозии.
Хранение и эксплуатация
Срок хранения щелочного элемента больше, чем у солевого, за счёт герметичной конструкции, также он не столь требователен к условиям хранения. Щелочные батареи могут храниться до 30 месяцев без существенной потери ёмкости[12].
В отличие от солевых элементов, щелочные могут работать при большем разрядном токе[17]. Кроме того, отсутствует эффект «усталости» элемента, когда после работы на большой нагрузке происходит значительное падение напряжения на выводах элемента, и для восстановления его работоспособности требуется определённое время «отдыха». Однако при коротком замыкании или установке в неверной полярности также возможна течь электролита.
Области применения
Щелочной элемент имеет то же рабочее напряжение, что и обычный марганцево-цинковый при большей ёмкости, разрядном токе, сроке хранения и рабочем диапазоне температур. Щелочные элементы выпускаются в тех же типоразмерах, что и солевые, и потому могут применяться в тех же приборах, например, в фонарях, электронных игрушках, переносных магнитофонах и т. д. Однако, за счёт лучших разрядных характеристик возможно применение их как в устройствах, потребляющих значительный ток (фотовспышки, радиоуправляемые модели), так и в устройствах, потребляющих относительно небольшой ток в течение длительного времени (электронные часы)[18].
Сравнение солевых и щелочных элементов
Благодаря такой конструкции, у щелочного элемента есть следующие особенности:
- Отсутствие расхода электролита, а значит меньшее его количество, необходимое для работы
- Анодом является порошкообразный цинк, а не цинковый стакан, поэтому реакция идёт на значительно большей поверхности.
- Меньше газовыделение, благодаря чему элемент можно делать полностью герметичным[19].
Отсюда можно выделить следующие преимущества и недостатки:
Преимущества
- Ёмкость — в 1,5-10 раз больше, чем у солевых элементов, в зависимости от режима работы, при том же типоразмере элемента[20]
- Меньший саморазряд, длительный срок хранения[12]
- Лучшая работа при низких температурах[12]
- Лучшая работа при больших токах нагрузки[12]
- Меньше падение напряжения по мере разряда[18]
Недостатки
- Более высокая цена[21]
- Большая масса
- Неприемлемы способы восстановления работоспособности, применимые для солевых элементов. Однако существуют особые конструкции щелочных элементов, допускающие определённое количество (обычно до 25) перезарядок[22]. Такие элементы называют «Rechargeable Alkaline Manganese» (RAM, перезаряжаемые щелочные марганцевые).
Примечания
- ↑ 1 2 Популярная механика №5, 2015.
- ↑ ГОСТ Р 58593-2019 Источники тока химические. Термины и определения
- ↑ ГОСТ Р МЭК 60086-1-2010, Таблица 3 — Стандартизованные электрохимические системы.
- ↑ History of battery invention and development Архивная копия от 25 октября 2007 на Wayback Machine, allaboutbatteries.com (accessed Dec. 4, 2011)
- ↑ IEEE, Edison's Alkaline Battery, IEEE Global History Network (accessed Dec. 4, 2011)
- ↑ Gabriel Baird, "Greater Cleveland Innovations: Thomas Edison provided Lew Urry spark of idea for better alkaline battery, " Cleveland Plain Dealer, August 03, 2011 (web version Архивная копия от 29 ноября 2014 на Wayback Machine)
- ↑ Патент US2960558 A — Dry cell
- ↑ 1 2 3 Надежин, А. Батарейки Goodhelper Alkaline: дно пробито. Блог компании LampTest. Хабр (28 сентября 2022). Дата обращения: 29 сентября 2022. Архивировано 29 сентября 2022 года.
- ↑ 1 2 3 Надежин, А. Новая беда — батарейки уменьшенной ёмкости ECO-Alkaline. Пишет Алексей Надёжин. Livejournal (31 января 2022). Дата обращения: 29 сентября 2022. Архивировано 29 сентября 2022 года.
- ↑ 1 2 3 Лекланше элемент // Куна — Ломами. — М. : Советская энциклопедия, 1973. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 14).
- ↑ 1 2 3 Багоцкий, 1978.
- ↑ 1 2 3 4 5 Кромптон, 1986, с. 77.
- ↑ Багоцкий, 1981, с. 224.
- ↑ 1 2 3 Вересов, 1983, с. 92.
- ↑ Кромптон, 1986, с. 78−79.
- ↑ Багоцкий, 1981, с. 225.
- ↑ Кромптон, 1986, с. 79.
- ↑ 1 2 Кромптон, 1986, с. 79−80.
- ↑ Лаврус, 1995.
- ↑ Кромптон, 1986, с. 79−81.
- ↑ Кромптон, 1986, с. 80−81.
- ↑ Багоцкий, 1981, с. 227-229.
Литература
- Химические источники тока / Багоцкий В. С. // Франкфурт — Чага. — М. : Советская энциклопедия, 1978. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 28).
- Вересов, Г. П. Электропитание бытовой радиоэлектронной аппаратуры. — М. : Радио и связь, 1983. — С. 85—95. — 128 с. : ил.
- Китаев, В. В. Электропитание устройств связи : уч / В. В. Китаев, А. А. Бокуняев, М. Ф. Колканов. — М. : Связь, 1975. — С. 225—235. — 328 с. : ил. — 24 000 экз. — УДК 621.39:621.311.6(075.8)(G).
- Костиков, В. Г. Источники электропитания электронных средств : Схемотехника и конструирование : Учебник для ВУЗов / В. Г. Костиков, Е. М. Парфенов, В. А. Шахнов. — 2 изд. — М. : Горячая линия — Телеком, 2001. — 344 с. — 3000 экз. — ISBN 5-93517-052-3.
- Кромптон, Т. Первичные источники тока = Small Batteries. Volume 2. Primary Cells. T. R. Crompton. The Macmillan Press Ltd., London, Basingstocke. 1982 : [пер. с англ.] / Под ред. канд. хим. наук Ю. А. Мазитова. — М. : Мир, 1986. — С. 76—96. — 328 с. : ил. — ББК 31.251. — УДК 621.355(G).
- ГОСТ 15596-82 : Источники тока химические. Термины и определения : (С изменением № 1.) Дата введения 1982-07-01.
- ГОСТ Р МЭК 60086-1-2010 : Батареи первичные. Часть 1. Общие требования : Дата введения 2011-07-01.
- Работает дольше // Популярная механика : журн. — 2015. — № 5 (151) (май). — [На сайте журн. опубл. под назван. «Кем и когда была изобретена щелочная батарейка?»].
- Hamade, R. Life Cycle Analysis of AA Alkaline Batteries : [англ.] / R. Hamade, R. Al Ayache, M. B. Ghanem … [et al.] // Procedia Manufacturing : журн. — 2020. — Vol. 43. — P. 415–422. — doi:10.1016/j.promfg.2020.02.193.
- Лаврус, В. Батарейки и аккумуляторы : справочн.. — К. : НиТ, 1995. — 42 с. — (Информационное Издание ; вып. 1).
- Багоцкий, В. С. Химические источники тока. / В. С. Багоцкий, А. М. Скундин. — М. : Энергоиздат, 1981. — С. 223−229. — 360 с.
Ссылки
- Марганцево-цинковые батарейки. PowerInfo.ru.
- Батарея электропитания. Энциклопедия Кругосвет.




![{\displaystyle {\ce {ZnO + 2KOH + H_2O = K_2[Zn(OH)_4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1fa3f44d99052c09c6cea35600fd3fca6c64223)
















