Щёлочи
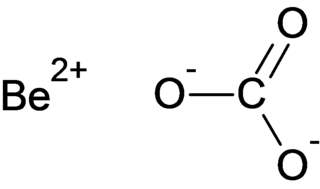
Щёлочи (в рус. языке от слова «щёлок»; производное от того же корня, что и др.-исл. skola «стирать»[1]) — гидроксиды щелочных, щелочноземельных металлов (кроме амфотерного гидроксида бериллия и обладающего слабыми основными свойствами гидроксида магния, они практически нерастворимы в воде) и таллия (гидроксид таллия(I) — является щелочью, несмотря на то что таллий это постпереходный металл, но гидроксид таллия(III) уже не является щелочью — это слабое основание, не растворимое в воде). К щелочам относятся хорошо растворимые в воде основания. При электролитической диссоциации щёлочи образуют анионы OH− и катион металла.
К щелочам относятся гидроксиды металлов подгрупп IA и IIA (начиная с кальция) периодической системы химических элементов, например NaOH (едкий натр), KOH (едкое кали), Ba(OH)2 (едкий барий). В качестве исключений к щелочам относят гидроксид одновалентного таллия TlOH, который хорошо растворим в воде и является сильным основанием, и гидроксид европия(II) Eu(OH)2. «Едкие щёлочи» — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH и цезия CsOH. Название «едкая щёлочь» обусловлено свойством разъедать кожу и слизистые оболочки (вызывая сильные химические ожоги), бумагу и другие органические вещества.
Из-за очень большой химической активности щелочных металлов едкие щёлочи долгое время не удавалось разложить и они потому считались простыми веществами. Одним из первых предположение о сложном составе едких щелочей высказал Лавуазье. Основываясь на своей теории о том, что все простые вещества могут окисляться, Лавуазье решил, что едкие щёлочи — это уже окисленные сложные вещества. Однако подтвердить это удалось лишь Дэви в начале XIX века после применения им электрохимии[2].
Физические свойства
Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твёрдые, белые (кроме гидроксида цезия — он выглядит грязно-бежевым), очень гигроскопичные вещества. Щёлочи — это сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением, причем вода в растворе может даже закипеть, что очень опасно. Сила основания и растворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Самые сильные щёлочи — гидроксид цезия (поскольку из-за очень малого периода полураспада гидроксид франция не получен в макроскопических количествах) в группе Ia и гидроксид радия в группе IIa. Кроме того, едкие щёлочи растворимы в этаноле и метаноле.
Химические свойства
Щёлочи проявляют осно́вные свойства. В твёрдом состоянии все щёлочи поглощают H2O, а также CO2 (также и в состоянии раствора) из воздуха, постепенно превращаясь в карбонаты. Щёлочи широко применяются в промышленности.
Качественные реакции на щёлочи
Водные растворы щелочей изменяют окраску индикаторов.
| Индикатор и номер перехода | х[3] | Интервал pH и номер перехода | Цвет щелочной формы | |
|---|---|---|---|---|
| Метиловый фиолетовый | 0,13-0,5 [I] | зелёный | ||
| Крезоловый красный [I] | 0,2-1,8 [I] | жёлтый | ||
| Метиловый фиолетовый [II] | 1,0-1,5 [II] | синий | ||
| Тимоловый синий [I] | К | 1,2-2,8 [I] | жёлтый | |
| Тропеолин 00 | О | 1,3-3,2 | жёлтый | |
| Метиловый фиолетовый [III] | 2,0-3,0 [III] | фиолетовый | ||
| (Ди)метиловый жёлтый | О | 3,0-4,0 | жёлтый | |
| Бромфеноловый синий | К | 3,0-4,6 | сине-фиолетовый | |
| Конго красный | 3,0-5,2 | синий | ||
| Метиловый оранжевый | О | 3,1-(4,0)4,4 | (оранжево-)жёлтый | |
| Бромкрезоловый зелёный | К | 3,8-5,4 | синий | |
| Бромкрезоловый синий | 3,8-5,4 | синий | ||
| Лакмоид | К | 4,0-6,4 | синий | |
| Метиловый красный | О | 4,2(4,4)-6,2(6,3) | жёлтый | |
| Хлорфеноловый красный | К | 5,0-6,6 | красный | |
| Лакмус (азолитмин) | 5,0-8,0 (4,5-8,3) | синий | ||
| Бромкрезоловый пурпурный | К | 5,2-6,8(6,7) | ярко-красный | |
| Бромтимоловый синий | К | 6,0-7,6 | синий | |
| Нейтральный красный | О | 6,8-8,0 | янтарно-жёлтый | |
| Феноловый красный | О | 6,8-(8,0)8,4 | ярко-красный | |
| Крезоловый красный [II] | К | 7,0(7,2)-8,8 [II] | тёмно-красный | |
| α-Нафтолфталеин | К | 7,3-8,7 | синий | |
| Тимоловый синий [II] | К | 8,0-9,6 [II] | синий | |
| Фенолфталеин[4] [I] | К | 8,2-10,0 [I] | малиново-красный | |
| Тимолфталеин | К | 9,3(9,4)-10,5(10,6) | синий | |
| Ализариновый жёлтый ЖЖ | К | 10,1-12,0 | коричнево-жёлтый | |
| Нильский голубой | 10,1-11,1 | красный | ||
| Диазофиолетовый | 10,1-12,0 | фиолетовый | ||
| Индигокармин | 11,6-14,0 | жёлтый | ||
| Epsilon Blue | 11,6-13,0 | тёмно-фиолетовый | ||
Взаимодействие с кислотами

Щёлочи, как основания, взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации). Это одно из самых важных химических свойств щелочей.
Щёлочь + Кислота → Соль + Вода
- ;
- .
Взаимодействие с кислотными оксидами
Щёлочи взаимодействуют с кислотными оксидами с образованием соли и воды:
Щёлочь + Кислотный оксид → Соль + Вода
- ;
Взаимодействие с амфотерными оксидами
- .
Взаимодействие с переходными (амфотерными) металлами
Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды ( и др). Уравнения этих реакций в упрощённом виде могут быть записаны следующим образом:
- ;
- .
Реально в ходе этих реакций в растворах образуются гидроксокомплексы (продукты гидратации указанных выше солей):
- ;
- ;
Взаимодействие с растворами солей
Растворы щелочей взаимодействуют с растворами солей, если образуется нерастворимое основание или нерастворимая соль:
Раствор щёлочи + Раствор соли → Новое основание + Новая соль
- ;
- ;
Получение
Растворимые основания получают различными способами.
Электролиз растворов солей щелочных/щёлочноземельных металлов
Путём электролиза хлоридов щелочных металлов
- ;
Реакцию нужно проводить под вытяжкой, так как выделяющийся хлор очень вреден для здоровья.
Реакция воды с Щелочными/Щёлочноземельными металлами
Реакцией воды с металлами IA группы и IIA группы, можно получить гидроксид и водород, который может самовоспламениться из-за высоких температур реакции.
- ;
Реакция воды с оксидами и пероксидами Щелочных/Щелочноземельных металлов
Реакций оксид и пероксидов Щ и ЩЗ металлов с водой, можно получить основания, продукты реакции зависят от нагрева в случае пероксидов
- ;
- (t°);
- ;
Взаимодействие щелочей с растворимыми солями с образованием другой щелочи и нерастворимой соли
При реакции щелочей с растворимыми солями образуется новая соль (Для удачного исхода реакции, конечным продуктом должна быть именно нерастворимая соль иначе мы получим лишь раствор свободных ионов) и щелочь.
- ;
Реакция соли Щелочноземельного металла которая подвергается гидролизу.
При реакции солей ЩЗ металлов, которые готовы вступить в реакцию с водой (узнать это можно по таблице растворимости) образуется щелочь и кислота (в зависимости от кислотного аниона)
- (t°);
Применение
Щёлочи широко применяются в различных производствах и медицине; также для дезинфекции прудов в рыбоводстве и как удобрение, в качестве электролита для щелочных аккумуляторов.
В почвоведении
Слабощелочная почва в почвоведении — это почва, водородный показатель которой выше 7,3. Большинство растений предпочитает слабокислые почвы (с pH от 6,0 до 6,8)[5]. Кочанная капуста предпочитает щелочные почвы, и это может помешать другим растениям.
Примечания
- ↑ Щёлок Архивная копия от 9 декабря 2017 на Wayback Machine // Словарь Фасмера
- ↑ А. С. Арсеньев. Анализ развивающегося понятия. М., «Наука», 1067. С. 332.
- ↑ *Столбец «х» — характер индикатора: К—кислота, О—основание.
- ↑ Фенолфталеин в сильно щелочной среде обесцвечивается. В среде концентрированной серной кислоты также он даёт красную окраску, обусловленную строением катиона фенолфталеина, хотя и не такую интенсивную. Эти малоизвестные факты могут привести к ошибкам при определении реакции среды.
- ↑ Chambers's Encyclopaedia[англ.]. — 1888.
Литература
- Колотов С. С. Щёлочи // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Едкие щёлочи // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2. (CC BY-SA 3.0)
При написании этой статьи использовался материал из издания «Казахстан. Национальная энциклопедия» (1998—2007), предоставленного редакцией «Қазақ энциклопедиясы» по лицензии Creative Commons BY-SA 3.0 Unported.







![{\displaystyle {\mathsf {Zn+2NaOH+2H_{2}O\longrightarrow Na_{2}[Zn(OH)_{4}]+H_{2}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12cdf879b7b827048dad4f4e69d884063b95d7a9)
![{\displaystyle {\mathsf {2Al+2KOH+6H_{2}O\longrightarrow 2K[Al(OH)_{4}]+3H_{2}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a11523f576df15240faad56120b016d9a682eefe)